题目内容
7.磷单质及其化合物在工业生产中有着广泛的应用.白磷可用于制备高纯度的磷酸(磷酸结构式为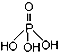 ),次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:
),次磷酸钠(NaH2PO2)可用于化学镀镍等等.完成下列填空:(1)NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为H<O<P<Na.
(2)写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式H++AlO2-+H2O?Al(OH)3?Al3++3OH-.
(3)磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂.其水溶液呈酸性的原因是磷酸二氢根离子电离程度大于水解程度.(请用文字描述)
(4)次磷酸钠(NaH2PO2)可用于化学镀镍.化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应:1Ni2++1H2PO2-+→1Ni+1H2PO3-+2H+.请完成并配平上述反应离子方程式.该反应的还原产物是Ni,反应中转移1摩尔电子时,理论上产生金属镍29.5 克.
分析 (1)NaH2PO2中涉及到四种元素为Na、H、P和O,原子的电子层数越多,原子半径越大,若电子层相同,核电荷数越大,原子半径越小;
(2)根据磷元素所在的周期及离子电子层越少、核电荷数越大离子半径越小判断满足条件的元素名称,写出其最高价氧化物对应的水化物的电离方程式;
(3)磷酸二氢钠在溶液中存在水解和电离两个过程,溶液显示酸性,说明磷酸二氢根离子电离程度大于其水解程度;
(4)根据氧化还原反应中化合价变化及质量守恒定律判断反应物和生成物,并配平反应方程式、判断还原产物,依据化学反应方程式计算转移电子数.
解答 解:(1)NaH2PO2中含有的元素中,H原子电子层最少,原子半径最小,其次是氧原子的原子半径,钠原子和磷原子都含有三个电子层,磷原子的核电荷数大于钠原子,所以磷原子的原子半径小于钠原子,所以它们的原子半径关系为H<O<P<Na,
故答案为:H<O<P<Na;
(2)磷位于第三周期,第三周期中阳离子失去电子,电子层减少一层,离子半径最小,离子的核电荷数越大,离子半径越小,所以铝离子的半径最小;铝元素最高价氧化物对应的水化物为氢氧化铝,其电离方程式为:H++AlO2-+H2O?Al(OH)3?Al3++3OH-,
故答案为:H++AlO2-+H2O?Al(OH)3?Al3++3OH-;
(3)磷酸二氢钠的溶液中,磷酸二氢根离子电离程度大于水解程度,所以其水溶液显示酸性,
故答案为:磷酸二氢根离子电离程度大于水解程度;
(4)由氧化还原反应中化合价升降相等进行配平:镍元素的化合价降低了2价,磷元素的化合价升高的2价,根据原子守恒结合电荷守恒可得配平的方程式为:H2O+Ni2++H2PO2-═Ni+H2PO3-+2H+,镍离子被还原成金属Ni,还原产物为Ni,此过程转移2mol电子,故反应中转移1摩尔电子时,理论上产生金属镍59×$\frac{1}{2}$=29.5克,
故答案为:1;1;H2O;1;1;2H+;Ni;29.5.
点评 本题考查了原子结构与元素性质的关系、氧化还原反应的配平、粒子半径大小比较等知识,题目难度中等,试题涉及的内容较多,题量较大,充分考查了学生的分析能力及灵活应用能力.

 步步高达标卷系列答案
步步高达标卷系列答案| A. | 反应①、②、③都是氧化还原反应 | |
| B. | 反应①中H2O2被还原 | |
| C. | 氧化性:KMnO4>O2 | |
| D. | 每生成1mol F2,上述反应共转移2mol电子 |
(1)工业上可用CO2和H2反应合成甲醇,已知25℃、101kPa下:
H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H2=-242kJ•mol-1
CH3OH(g)+$\frac{3}{2}$O2(g)═CO2(g)+2H2O△H2=-676kJ•mol-1
①写出CO2与H2反应生成CH3OH(g)与H2O(g)的热化学方程式CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H=-50 kJ/mol.
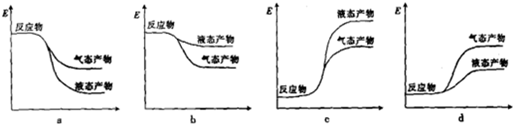
②下列表示合成甲醇反应的能量变化示意图中正确的是a(填字母).
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)?H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1mol•L-1,c(H2O)=2mol•l-1,则达到平衡时H2O的转化率为33.3%.
(2)CO和H2反应也能合成甲醇:CO(g)+2H2?CH3OH(g)△H=-90.1kJ•mol-1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质的浓度(mol•L-1)变化如下表所示(前6min没有改变条件):
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.2 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
②若6~8min时只改变了一个条件,则改变的条件是加入1mol氢气,第8min时,该反应是否达到平衡状态?不是(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性高;
Ⅱ.温度低,反应速率慢,单位时间内的产量低,而正反应为放热反应,温度过高,转化率降低.
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL0.1000mol•L-1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH>(填“<”“>”或“=”)7,原因是HCOO-+H2O?+HCOOH+OH-(用离子方程式表示).
| A. | 电能是二级能源 | B. | 水力是二级能源 | ||
| C. | 天然气是二级能源 | D. | 焦炉气是一级能源 |
| A. | 35.5:108 | B. | 16:137 | C. | 8:1 | D. | 108:35.5 |
①CO(g)+H2(g)═CH3OH(g)△H1
②CO2(g)+H2(g)═CH3OH(g)+H2O(g)△H2
③CO2(g)+H2(g)═CO(g)+H2O(g)△H3
回答下列问题:
| 化学键 | H-H | C-O | C$\stackrel{←}{=}$O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=-99kJ.mol-1,已知△H2=-58kJ.mol-1,则△H3=+41kJ.mol-1
(2)反应①的化学平衡常数K的表达式为K=$\frac{c(CH{\;}_{3}OH)}{c(CO)×c{\;}^{2}(H{\;}_{2})}$;图1中能正确反映平衡常数K随温度变化关系的曲线为a(填曲线标记字母),其判断理由是反应①正反应为放热反应,平衡常数随温度升高而减小.

(3)合成气的组成$\frac{n({H}_{2})}{n(CO+C{O}_{2})}$=2.60时体系中的CO平衡转化率(a)与温度和压强的关系如图2所示.CO平衡转化率a(CO)值随温度升高而减小(填“增大”或“减小”),其原因是反应①正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡体系中CO的量增大,反应③为吸热反应,升高温度,平衡向正反应方向移动,又使平衡体系中CO的增大,总结果,随温度升高,CO的转化率减小.

 的合成路线如图(部分反应条件省略)
的合成路线如图(部分反应条件省略)
 (注明反应的条件).
(注明反应的条件). .
.