题目内容
15.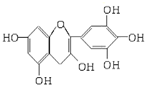 茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )
茶是我国的传统饮品,茶叶中含有的茶多酚可以替代食品添加剂中对人体有害的合成抗氧化剂,用于多种食品保鲜等,如图所示是茶多酚中含量最高的一种儿茶素A的结构简式,关于这种儿茶素A的有关叙述正确的是( )①等质量的儿茶素A分别与足量的金属钠和氢氧化钠反应,消耗金属钠和氢氧化钠的物质的量之比为1:1
②分子式为C15H12O7
③1mol儿茶素A与足量的浓溴水反应,最多消耗4molBr2
④1mol儿茶素A在一定条件下最多能与7molH2加成.
| A. | ②④ | B. | ①④ | C. | ②③ | D. | ③④ |
分析 有机物含有酚羟基,可发生取代、氧化和显色反应,含有醇羟基,可发生取代、消去和氧化反应,以此解答该题.
解答 解:①分子中含有5个酚羟基,可与氢氧化钠反应,含有5个酚羟基和1个醇羟基,都可与钠反应,则反应消耗金属钠和氢氧化钠的物质的量之比为6:5,故错误;
②由有机物结构简式可知分子式为C15H12O7,故正确;
③分子中酚羟基共有4个邻位后对位H原子可被取代,则1mol儿茶素A与足量的浓溴水反应,最多消耗Br2 4mol,故正确;
④分子中含有2个苯环,则1mol儿茶素A在一定条件下最多能与6ol H2加成,故错误;
故选C.
点评 本题考查有机物的结构和性质,为高考常见题型,侧重于学生的分析能力的考查,注意把握有机物的结构和官能团的性质为解答该类题目的关键,题目难度不大.

练习册系列答案
相关题目
6.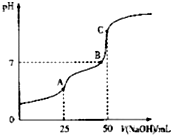 25°C时,向25ml 0.1wol•L-1 H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )
25°C时,向25ml 0.1wol•L-1 H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )
 25°C时,向25ml 0.1wol•L-1 H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )
25°C时,向25ml 0.1wol•L-1 H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )| A. | HC2O4-的电离程度大于其水解程度 | |
| B. | B点时溶液中含有NaHC2O4和Na2C2O4 | |
| C. | A点时,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| D. | C点时,c(Na+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+) |
3.下列物质与其用途完全符合的是( )
①Na2O2-供氧剂
②晶体Si-太阳能电池
③AgI-人工降雨
④NaCl-制纯碱
⑤Al2O3-焊接钢轨
⑥NaClO-消毒剂
⑦Fe2O3-红色油漆或涂料
⑧SO2-食品防腐剂
⑨NH3-制冷剂
⑩水玻璃-耐火材料.
①Na2O2-供氧剂
②晶体Si-太阳能电池
③AgI-人工降雨
④NaCl-制纯碱
⑤Al2O3-焊接钢轨
⑥NaClO-消毒剂
⑦Fe2O3-红色油漆或涂料
⑧SO2-食品防腐剂
⑨NH3-制冷剂
⑩水玻璃-耐火材料.
| A. | ①④⑤⑧⑨ | B. | ①②③⑥⑦⑨ | C. | ①②③④⑥⑦⑨⑩ | D. | ①②③④⑥⑦⑨ |
7.工业上曾经通过反应“3Fe+4NaOH$\stackrel{1100℃}{?}$Fe3O4+2H2↑+4Na↑”生产金属钠.下列有关说法正确的是( )
| A. | 用磁铁可以将Fe与Fe3O4分离 | |
| B. | 将生成的气体在空气中冷却可获得钠 | |
| C. | 该反应条件下铁的氧化性比钠强 | |
| D. | 每生成1molH2,转移的电子数约为4×6.02×1023 |
4.除去下列物质中所含少量杂质(括号内为杂质),所选的试剂和分离方法能达到实验目的是( )
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 苯(甲苯) | 酸性高锰酸钾溶液 NaOH溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
5.某同学用15mol•L-1浓硫酸,按下列步骤配2505mL0.1mol•L-1H2SO4溶液,请回答有关问题.
(1)本实验不需要用到的仪器是c
a.玻璃棒 b.烧杯 c.天平 d胶头滴管
(2)在进行④步操作时,不慎将溶液溅到容量瓶外,则配制溶液的浓度将偏低(填写偏高、偏低、不影响.下同).若配制时容量瓶没有干燥,则配制溶液浓度将不影响.
(3)某研究人员应用如图研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸汽.请回答下列问题:
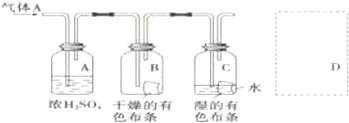
①浓硫酸的作用是干燥剂.
②通入Cl2后,从集气瓶B中干燥的有色布条的现象可得出的结论是干燥氯气不具有漂白性从集气瓶C中湿润的有色布条的现象可得出的结论是次氯酸具有漂白性.
③从物质性质的方面来看,这样的实验设计还存在事故隐患,请在图D处以图的形式表明克服事故隐患的措施.
| 实验步骤 | 有关问题 |
| (1)计算所需浓硫酸的体积 | 需取浓硫酸(1.7)mL |
| (2)量 取浓硫酸 | 需要用到的主要仪器是:5mL量筒 |
| (3)将 浓硫酸沿着玻璃棒缓缓注入盛有水的烧杯中并搅拌 | 该操作要做到胆大心细,杜绝事故发生 |
| (4)待溶液冷却至室温,将烧杯中溶液转移至250mL容量瓶中 | 要注意把洗涤液一并转移至容量瓶中 |
| (5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时当加水至刻度线1-2cm处后的正确操作是:改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切 |
a.玻璃棒 b.烧杯 c.天平 d胶头滴管
(2)在进行④步操作时,不慎将溶液溅到容量瓶外,则配制溶液的浓度将偏低(填写偏高、偏低、不影响.下同).若配制时容量瓶没有干燥,则配制溶液浓度将不影响.
(3)某研究人员应用如图研究物质的性质,其中气体A的主要成分是氯气,杂质是空气和水蒸汽.请回答下列问题:

①浓硫酸的作用是干燥剂.
②通入Cl2后,从集气瓶B中干燥的有色布条的现象可得出的结论是干燥氯气不具有漂白性从集气瓶C中湿润的有色布条的现象可得出的结论是次氯酸具有漂白性.
③从物质性质的方面来看,这样的实验设计还存在事故隐患,请在图D处以图的形式表明克服事故隐患的措施.