题目内容
5.下列中和反应中放出热量最多的是( )| A. | 100 mL 0.3 mol/L 的HCl 和50 mL 0.3 mol/L 的NaOH相混合 | |
| B. | 80mL 0.3 mol/L 的HCl 和80 mL 0.3 mol/L 的NaOH溶液相混合 | |
| C. | 80mL 0.3 mol/L 的H2SO4 和80 mL 0.3 mol/L 的NaOH溶液相混合 | |
| D. | 50mL 0.3 mol/L 的H2SO4 和50 mL 0.6 mol/L 的NaOH溶液相混合 |
分析 中和反应生成水的物质的量的越多,则放出的热量越多,注意计算各物质的物质的量,计算生成水的物质的量,进而比较放出的热量的多少即可.
解答 解:A.n(HCl)=0.03mol,n(NaOH)=0.015mol,则生成水0.015mol;
B.n(HCl)=0.024mol,n(NaOH)=0.024mol,则生成水0.024mol;
C.n(H2SO4)=0.024mol,n(NaOH)=0.024mol,则生成水0.024mol;
D.n(H2SO4)=0.015mol,n(NaOH)=0.03mol,则生成水0.03mol;
则D生成的水最多,放出的热量最多,
故选D.
点评 本题考查物质的量的计算,题目难度不大,注意判断反应的过量问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.已知R2-离子的核内有n个中子,R的质量数为M,则mgR2-离子里含有电子的物质的量为( )
| A. | $\frac{m(M-n)}{M}$ | B. | $\frac{M-n+2}{Mm}$ | C. | $\frac{m(M-n+2)}{M}$ | D. | $\frac{m(M-n-2)}{M}$ |
20.2007年诺贝尔化学奖得主 Gerhard Ertl 对金属Pt表面催化CO氧化反应的模型进行了深入研究.下列关于${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt的说法正确的是( )
| A. | ${\;}_{78}^{202}$ Pt和${\;}_{78}^{198}$Pt的中子数相同,互称为同位素 | |
| B. | ${\;}_{78}^{202}$ Pt和${\;}_{78}^{198}$Pt的质子数相同,互称为同位素 | |
| C. | ${\;}_{78}^{202}$ Pt和${\;}_{78}^{198}$Pt不能互称为同位素 | |
| D. | ${\;}_{78}^{202}$Pt和${\;}_{78}^{198}$Pt是同一种核素 |
10.将等物质的量的X和Y混合气体,通入密闭容器中发生如下反应:X(g)+2Y(g)?2Z(g),平衡时混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于( )
| A. | 33% | B. | 40% | C. | 50% | D. | 67% |
17.下列各组物质中化学键的类型完全相同的是( )
| A. | NaCl MgCl2 Na2O | B. | H2O Na2O CO2 | ||
| C. | CaCl2 NaOH H2SO4 | D. | NH4Cl H2O CO2 |
19.下表是部分短周期元素的信息,用化学用语回答下列问题.
(1)元素A在周期表中的位置第二周期ⅣA族.B的某种核素中中子数比质子数多1,则表示该核素的原子符号为715N.
(2)写出钙与M原子个数比为1:2化合物的电子式 ,钙与A原子个数比为1:2化合物含有的化学键类型(填离子键、共价键或非极性键)离子键和非极性键共价键.
,钙与A原子个数比为1:2化合物含有的化学键类型(填离子键、共价键或非极性键)离子键和非极性键共价键.
(3)M2-、D+、G2-离子半径大小顺序是S2->O2->Na+(用离子符号回答).
(4)由A、B、M及氢四种原子构成的分子A2H5BM2,既可以和盐酸反应又可以和氢氧化钠溶液反应,写出A2H5BC2的名称甘氨酸.
(5)某同学设计实验证明A、B、F的非金属性强弱关系.
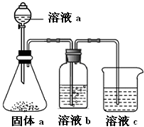
①溶液a和b分别为硝酸,饱和NaHCO3溶液.
②溶液c中的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-.
(6)将0.5mol D2M2投入100mL 3mol/L ECl3溶液中,转移电子的物质的量为0.5mol.
(7)工业上冶炼E,以石墨为电极,阳极产生的混合气体的成分为O2、CO2(或CO).
| 元素代号 | A | B | F |
| 原子半径/nm | 0.077 | 0.075 | 0.117 |
| 主要化合价 | +4、-4 | +5、-3 | +4、-4 |
| 元素 | D | M | G | E |
| 性质 结构 信息 | 单质制成的高压灯,发出的黄光透雾力强、射程远. | 氢化物常温下呈液态,M的双原子阴离子有18个电子 | 原子核外的M层比L层少2个电子. | +3价阳离子的核外电子排布与氖原子相同. |
(2)写出钙与M原子个数比为1:2化合物的电子式
 ,钙与A原子个数比为1:2化合物含有的化学键类型(填离子键、共价键或非极性键)离子键和非极性键共价键.
,钙与A原子个数比为1:2化合物含有的化学键类型(填离子键、共价键或非极性键)离子键和非极性键共价键.(3)M2-、D+、G2-离子半径大小顺序是S2->O2->Na+(用离子符号回答).
(4)由A、B、M及氢四种原子构成的分子A2H5BM2,既可以和盐酸反应又可以和氢氧化钠溶液反应,写出A2H5BC2的名称甘氨酸.
(5)某同学设计实验证明A、B、F的非金属性强弱关系.

①溶液a和b分别为硝酸,饱和NaHCO3溶液.
②溶液c中的离子方程式为SiO32-+CO2+H2O=H2SiO3↓+CO32-.
(6)将0.5mol D2M2投入100mL 3mol/L ECl3溶液中,转移电子的物质的量为0.5mol.
(7)工业上冶炼E,以石墨为电极,阳极产生的混合气体的成分为O2、CO2(或CO).
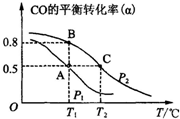 利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)?CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
利用CO和H2合成甲醇,其反应的化学方程式为CO(g)+2H2(g)?CH3OH(g).今在一容积可变的密闭容器中,充有10mol CO和20mol H2用于合成甲醇.CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示: