题目内容
pH=1的两种酸溶液X和Y分别与足量的锌反应,酸X比酸Y产生的氢气多,下列结论正确的是( )
| A、X是强酸,Y是弱酸 |
| B、X是弱酸,Y是强酸 |
| C、X是二元酸,Y是一元酸 |
| D、无法判断X、Y的上述性质 |
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:pH=1的两种酸溶液,强酸完全电离,弱酸部分电离,与足量的金属锌反应,酸性弱的酸产生的氢气多.
解答:
解:pH=1的两种酸溶液,强酸完全电离,弱酸部分电离,与足量的金属锌反应,弱酸中氢离子被消耗会继续电离出氢离子,则产生的氢气多,酸X比酸Y产生的氢气多,所以X酸性比Y弱,但是Y不一定为强酸.
故选D.
故选D.
点评:本题考查电解质在水溶液中的电离,题目难度不大,注意只能判断出酸性相对强弱,但不一定是强酸.

练习册系列答案
相关题目
电解NaCl溶液的装置如图所示,下列说法不正确的是( )
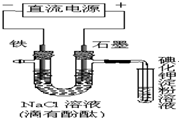

| A、铁电极上的电极反应式为Fe-2e-=Fe2+ |
| B、溶液中Na+由石墨电极向铁电极移动 |
| C、通电一段时间后,可看到铁电极附近溶液变红 |
| D、通电一段时间后,可看到试管中溶液变蓝 |
将Cu放入0.1mol?L-1的FeCl3溶液中,反应一定时间后取出Cu,溶液中Fe2+、Fe3+的浓度比为3:2,则Cu2+和Fe3+的物质的量之比为( )
| A、3:2 | B、3:5 |
| C、4:3 | D、3:4 |
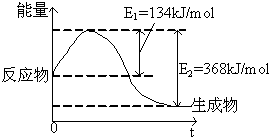 如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.
如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.
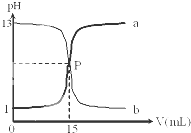 如图是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空:
如图是盐酸与氢氧化钠的滴定曲线a和b,试认真分析后填空: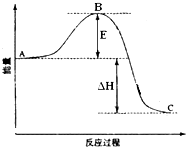 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示.已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99kJ?mol-1.请回答下列问题: Ⅰ.甲醇是一种新型的能源.
Ⅰ.甲醇是一种新型的能源.