题目内容
X、Y、Z为三种气体,把amolX和bmolY充入一密闭容器中,发生反应X+2Y?2Z.达到平衡时,若他们的物质的量满足:n(X)+n(Y)=n(Z)则Y的转化率为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:化学平衡的计算
专题:化学平衡专题
分析:某反应物的转化率(α)=
×100%,根据反应X+2Y?2Z,利用三段式法计算.
| 已消耗反应物物质的量 |
| 反应物起始的物质的量 |
解答:
解:利用三段式法计算:
X(g)+2Y(g)?2Z(g),
起始:amol bmol 0
转化:xmol 2xmol 2xmol
平衡:(a-x)mol (b-2x)mol 2xmol
所以(a-x)mol+(b-2x)=2xmol,
解得x=
mol,
Y的转化率为
×100%=
×100%,
故选B.
X(g)+2Y(g)?2Z(g),
起始:amol bmol 0
转化:xmol 2xmol 2xmol
平衡:(a-x)mol (b-2x)mol 2xmol
所以(a-x)mol+(b-2x)=2xmol,
解得x=
| a+b |
| 5 |
Y的转化率为
| ||
| bmol |
| 2(a+b) |
| 5b |
故选B.
点评:本题主要考查化学平衡的计算,题目难度不大,注意三段式计算方法的运用.在选择题中排除法是一种常用方法,可以简化过程,这种计算题排除需清楚原理与过程,体现学生综合能力.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
下列反应的离子方程式中正确的是( )
| A、硫酸亚铁溶液中加入用硫酸酸化过的过氧化氢溶液:Fe2++2H++H2O2=Fe3++2H2O |
| B、过量的二氧化硫通入漂白粉溶液中:ClO-+SO2+H2O=HClO+HSO3 |
| C、向氯化铝溶液中加入过量的氨水:Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
| D、碳酸氢铵溶液中加入过量的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O |
以下说法:①SO2、SiO2、CO均为酸性氧化物
②KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
③碱性氧化物一定是金属氧化物
④硫酸、火碱、纯碱、生石灰分别属于酸、碱、盐和氧化物
⑤二氧化硅的分子式为SiO2,酸性氧化物,能与NaOH溶液反应
⑥正四面体分子中键角一定是109°28′
⑦CO2 与SiO2化学性质相似物理性质也相似
⑧福尔马林、水玻璃、氨水均为混合物
⑨强电解质溶液的导电能力一定比弱电解质溶液的导电能力强.
其中正确的是( )
②KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质
③碱性氧化物一定是金属氧化物
④硫酸、火碱、纯碱、生石灰分别属于酸、碱、盐和氧化物
⑤二氧化硅的分子式为SiO2,酸性氧化物,能与NaOH溶液反应
⑥正四面体分子中键角一定是109°28′
⑦CO2 与SiO2化学性质相似物理性质也相似
⑧福尔马林、水玻璃、氨水均为混合物
⑨强电解质溶液的导电能力一定比弱电解质溶液的导电能力强.
其中正确的是( )
| A、①③④⑤⑥ | B、④⑥⑧⑨ |
| C、③④⑧ | D、②④⑦⑨ |
下列物质间的转化在给定条件下能够实现的是( )
①Al2O3
NaAlO2(aq)或Na[Al(OH)4](aq)
Al(OH)3
②S
SO3
H2SO4
③NaOH(aq)
NaHCO3
Na2CO3
④Fe2O3
FeCl3(aq)
无水FeCl3
⑤NH4Cl(s)
NH3
NH4HCO3.
①Al2O3
| NaOH(aq) |
| △ |
| CO2 |
②S
| O2 |
| 点燃 |
| H2O |
③NaOH(aq)
| 足量CO2 |
| △ |
④Fe2O3
| HCl(aq) |
| △ |
⑤NH4Cl(s)
| 熟石灰 |
| △ |
| H2O、CO2 |
| A、①③⑤ | B、②③④ |
| C、②④⑤ | D、①④⑤ |
近年来,食品安全领域相继发生“面粉增白剂”、“彩色馒头”、“毒豆芽”、“牛肉膏”、“硫黄姜”、“地沟油”等事件,温家宝总理痛斥不法分子“道德素质严重滑坡”.下列有关说法错误的是( )
| A、对于能够改善食品的色、香、味,并有防腐、保鲜作用的食品添加剂,不必限量使用 |
| B、“面粉增白剂”中的CaO2具有强氧化性 |
| C、制作“毒豆芽”所用的亚硝酸钠(NaNO2)和使猪肉变“牛肉”时掺入的硼砂(Na2B4O7?10H2O)都属于钠盐 |
| D、“硫黄姜”又黄又亮,可能是在用硫黄熏制的过程中产生的SO2所致 |
电解NaCl溶液的装置如图所示,下列说法不正确的是( )
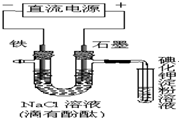

| A、铁电极上的电极反应式为Fe-2e-=Fe2+ |
| B、溶液中Na+由石墨电极向铁电极移动 |
| C、通电一段时间后,可看到铁电极附近溶液变红 |
| D、通电一段时间后,可看到试管中溶液变蓝 |
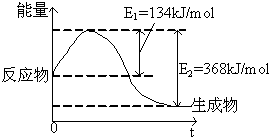 如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.
如图是在101kPa,298K条件下1mol NO2(g)和1mol CO(g)反应生成1mol CO2(g)和1mol NO(g)过程中的能量变化示意图.