题目内容
8.已知2Fe3++2I-═2Fe2++I2、Br2+2Fe2+═2Br-+2Fe3+.现向含有FeBr2、FeI2的某溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是( )①按I-、Fe2+、Br-的顺序还原性逐渐减弱;
②原溶液中Br-一定被氧化;
③通入氯气后原溶液中Fe2+一定被氧化;
④不能确定通入氯气后的溶液中是否还存在Fe2+;
⑤若取少量所得溶液,加入CCl4充分振荡后静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br-均被完全氧化.
| A. | ①②③④ | B. | ①③④⑤ | C. | ②④⑤ | D. | ①②③④⑤ |
分析 据氯气先氧化碘离子,然后氧化二价铁,最后氧化溴离子,向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,说明含有铁离子,则碘离子全部被氧化,二价铁部分或全部被氧化,溴离子可能被氧化来分析.
解答 解:氯气先氧化碘离子,然后氧化二价铁,最后氧化溴离子,向反应后的溶液中滴加KSCN溶液,结果溶液变为红色,说明碘离子全部被氧化,二价铁部分或全部被氧化,溴离子可能被氧化,
①氯气先氧化碘离子,然后氧化二价铁,最后氧化溴离子,则碘离子还原性最强,溴离子最弱,则还原性:I-、Fe2+、Br-的顺序逐渐减弱,故正确;
②原溶液中的Br-可能被氧化,也可能未被氧化,故错误;
③通入氯气之后原溶液中的二价铁部分或全部被氧化,故正确;
④通入氯气之后原溶液中的二价铁部分或全部被氧化,所以不能确定通入氯气之后的溶液中是否存在Fe2+,故正确;
⑤若取少量所得溶液,再加入CCl4溶液,静置、分液,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中的Br-被完全氧化,I-、Fe2+均被完全氧化,故正确;
故选B.
点评 本题考查学生氧化还原反应中氧化性和还原性强弱的知识,题目难度不大,侧重于氧化还原反应在离子反应中应用的考查.

练习册系列答案
相关题目
18.等量的铁分别与足量的盐酸、水蒸气在一定的条件下充分反应,则在相同的条件下,产生氢气的体积比是( )
| A. | 1:1 | B. | 2:3 | C. | 3:4 | D. | 4:3 |
18.A、B、C、D、E是原子序数依次增大的前四周期的常见元素.已知:
(1)写出E原子基态核外电子排布式1s22s22p63s23p63d104s1.比较B、C、D电负性的大小顺序C<N<O.(按由小到大)
(2)与C2互为等电子体的分子有CO,离子有CN-或C22-.
(3)E2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物(如图1),画出其中E2+离子与N、O原子间的化学键.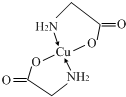 .
.
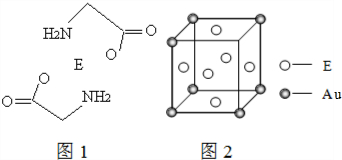
(4)E和金(Au)形成的合金的晶胞结构如图2,则该合金的化学式可表示为Cu3Au.
| A | 原子半径最小 |
| B | 核外3个能级上的电子数相等 |
| C | 其氢化物的沸点比同族相邻周期元素氢化物的沸点高 |
| D | 2p轨道上成对电子数与未成对电子数相等 |
| E | N层电子数为1,内层轨道全部排满电子 |
(2)与C2互为等电子体的分子有CO,离子有CN-或C22-.
(3)E2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物(如图1),画出其中E2+离子与N、O原子间的化学键.
 .
.(4)E和金(Au)形成的合金的晶胞结构如图2,则该合金的化学式可表示为Cu3Au.


 .
.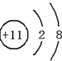 .
. 能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题:
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题: .
. ,A2C的结构式:H-O-H.
,A2C的结构式:H-O-H. .
.