题目内容
20. 能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题:
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题:(1)从能量的角度看,断开化学键要吸收能量,形成化学键要释放能量.
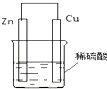
(2)在生产和生活中经常遇到化学能与电能的相互转化.如图是将化学能转化为电能的装置,负极电极反应式为Zn-2e-=Zn2+,发生氧化反应(填“氧化”或“还原”,下同).正极现象产生气泡,发生还原反应;发生反应时,电子由锌片流向铜片.当导线中有2mol电子通过时,正极上析出2g 氢气.
分析 (1)断开化学键要吸收能量,形成化学键要释放能量,据此回答;
(2)原电池是将化学能转化为电能的装置,其中活泼金属做负极发生氧化反应,正极得电子发生还原反应;根据原电池的工作原理结合电子转移进行计算即可.
解答 解:(1)在化学反应中,化学反应的实质是旧键的断裂和新键的生成,断开化学键要吸收能量,形成化学键要释放能量,故答案为:吸收能量,释放能量;
(2)原电池是将化学能转化为电能的装置,其中活泼金属Zn做负极,发生氧化反应Zn-2e-=Zn2+;正极氢离子得电子发生还原反应2H++2e-=H2↑,当导线中有2mol电子通过时,产生氢气是1mol,质量是2g.
故答案为:化学,电;Zn-2e-=Zn2+;氧化;产生气泡;还原;锌片;铜片;2g.
点评 本题考查化学反应的实质、原电池中电极反应式书写及电子守恒的计算知识,题目难度不大.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目
11.一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合如图的是( )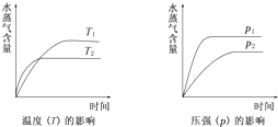

| A. | CH3CH2OH?CH2=CH2(g)+H2O(g);△H>0 | |
| B. | CO2(g)+H2(g)?CO(g)+H2O(g);△H>0 | |
| C. | CO2(g)+2NH3( g)?CO(NH2)2(s)+H2O(g);△H<0 | |
| D. | 2C6H5CH2CH3(g)+O2(g)?2C6H-5CH=CH2(g)+2H2O(g);△H<0 |
5.“绿色化学”是当今社会提出的一个新概念,在“绿色化学”工艺中,理想状态是反应中原子全部转化为欲制的产物,即原子利用率为100%.以下反应最符合绿色化学原子经济性要求的是( )
| A. | 铜和浓硝酸为原料生产硝酸铜 | B. | 甲烷与氯气制备一氯甲烷 | ||
| C. | 乙烯与HCl制取氯乙烷 | D. | 由反应2SO2+02?2SO3制SO3 |
12.下列各组中的关系互为同系物的是( )
| A. | C2H6和C3H8 | B. | CH3-CH2-CH2-CH3和 | ||
| C. | 1H和2H | D. | O2和O3 |
9.25℃时,0.1mol/L HCl中,下列说法正确的是( )
| A. | c(H+)×c(OH-)=1×10-14 | B. | 该溶液中由水电离出的c(H+)=1×10-7 | ||
| C. | c(H+)=c(OH-)=1×10-7 | D. | c(H+)×c(OH-)=1 |
10.如果你家里的食用花生油不小心混入了大量的水,利用你所学的知识,采用最简便的分离方法是( )
| A. | .蒸发 | B. | 分液 | C. | .蒸馏 | D. | 萃取 |

 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义.
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义.