题目内容
14.2013年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物三项组成.(1)机动车的尾气是雾霾形成的原因之一,近几年有人提出利用选择性催化剂利用汽油中挥发出来的C3H6催化还原尾气中的NO气体,请写出该过程的化学方程式:2C3H6+18NO=6CO2+6H2O+9N2
(2)我国北方到了冬季烧煤供暖所产生的废气也是雾霾的主要来源之一.经研究发现将煤炭在O2/CO2的气氛下燃烧,发现能够降低燃煤时NO的排放,主要反应为:
2NO(g)+2CO(g)?N2(g)+2CO2(g)△H
若①N2(g)+O2(g)?2NO(g)△H1=+180.5kJ•mol-1
②CO(g)?C(s)+$\frac{1}{2}$O2(g)△H2=+110.5kJ•mol-1
③C (s)+O2(g)?CO2(g)△H3=-393.5kJ•mol-1
则△H=-746.5kJ•mol-1.
(3)燃煤尾气中的SO2用NaOH溶液吸收形成NaHSO3溶液,在pH为4~7之间时电解,硫元素在铅阴极上被电解还原为Na2S2O4.Na2S2O4俗称保险粉,广泛应用于染料、印染、造纸、食品工业以及医学上.这种技术是最初的电化学脱硫技术之一.请写出该电解反应中阴极的电极方程式:2HSO3-+2H++2e-=S2O42-+2H2O
(4)SO2经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g)+O2(g)?2SO3(g).若在T1℃、0.1MPa条件下,往一密闭容器通入SO2和O2(其中n(SO2):n(O2)=2:1),测得容器内总压强与反应时间如图所示:
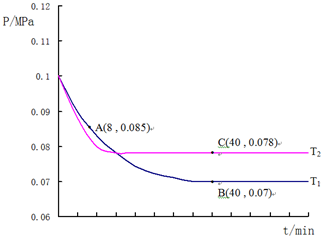
①该反应的化学平衡常数表达式:K=$\frac{{C}^{2}(S{O}_{3})}{{C}^{2}(S{O}_{2})×C({O}_{2})}$
②图中A点时,SO2的转化率为45%
③计算SO2催化氧化反应在图中B点的压强平衡常数K=24300(MPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
④若在T2℃,其他条件不变的情况下测得压强的变化曲线如图所示,则T1<T2(填“>”、“<”、“=”);其中C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正)>vA(逆) (填“>”、“<”、“=”).
分析 (1)C3H6催化还原尾气中的NO气体,可以得到无毒的气体氮气和二氧化碳;
(2)②×2+③×2-①得到2NO(g)+2CO(g)?N2(g)+2CO2(g),据此计算反应的焓变;
(3)电解反应中阴极上发生得电子的还原反应,根据反应原理来回答书写;
(4)①反应平衡常数K=$\frac{产物平衡浓度系数次幂之积}{反应物平衡浓度系数次幂之积}$;
②结合化学三行计算列式,依据图中A点时,气体物质的量0.085,依据开始和A点气体物质的量之比列式计算,转化率=$\frac{变化量}{起始量}$×100%;
③图中B点,依据化学三行列式计算用平衡分压代替平衡浓度计算,分压=总压×物质的量分数计算SO2催化氧化反应在图中B点的压强平衡常数;
④先拐先平温度高,达到平衡所需时间短,温度越高反应速率越大.
解答 解:(1)C3H6催化还原尾气中的NO气体,可以得到无毒的气体氮气和二氧化碳,即2C3H6+18NO=6CO2+6H2O+9N2,
故答案为:2C3H6+18NO=6CO2+6H2O+9N2;
(2))②×2+③×2-①得到2NO(g)+2CO(g)?N2(g)+2CO2(g),反应的焓变=2(+110.5kJ•mol-1)+2(-393.5kJ•mol-1)-(180.5kJ•mol-1)=-746.5kJ•mol-1,
故答案为:-746.5kJ•mol-1;
(3)电解反应中阴极上发生得电子的还原反应,2HSO3-+2H++2e-=S2O42-+2H2O,
故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;
(4)①2SO2(g)+O2(g)?2SO3,反应的平衡常数K=$\frac{{C}^{2}(S{O}_{3})}{{C}^{2}(S{O}_{2})×C({O}_{2})}$,
故答案为:$\frac{{C}^{2}(S{O}_{3})}{{C}^{2}(S{O}_{2})×C({O}_{2})}$;
②设氧气消耗物质的量为x,
2SO2(g)+O2(g)?2SO3
起始量(mol) 2a a 0
变化量(mol) 2x x 2x
平衡量(mol)2a-2x a-x 2x
图中A点时,气体物质的量0.085,则$\frac{2a-2x+a-x+2x}{2a+a}$=$\frac{0.085}{0.1}$,x=0.45a
SO2的转化率=$\frac{0.45a×2}{2a}$×100%=45%,
故答案为:45%;
③图中B点,设氧气消耗物质的量为y,
2SO2(g)+O2(g)?2SO3
起始量(mol) 2a a 0
变化量(mol) 2y y 2y
平衡量(mol) 2a-2y a-y 2y
B点气体物质的量为 0.007,则$\frac{2a-2y+a-y+2y}{2a+a}$=$\frac{0.07}{0.1}$,y=0.9a,
平衡常数K=$\frac{(0.007×\frac{1.8}{0.2a+0.1a+1.8a})^{2}}{(0.007×\frac{0.2a}{0.2a+0.1a+1.8a})^{2}×(0.007×\frac{0.1a}{0.2a+0.1a+1.8a})}$=24300(MPa)-1,
故答案为:24300(MPa)-1;
④图象分析可知,先拐先平温度高则T1<T2,C点是平衡状态,A点反应未达到平衡状态,其中C点的正反应速率vC(正)与A点的逆反应速率vA(逆)的大小关系为vC(正)>vA(逆)
故答案为:<;>.
点评 本题考查了化学平衡、化学反应速率影响因素的分析应用,图象变化和数值的计算是解题关键,题目难度中等.

| A. | 氯化铁腐蚀铜板:Fe3++Cu═Fe2++Cu2+ | |
| B. | 实验室制氯气:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++2Cl2↑+2H2O | |
| C. | 稀硫酸中加氢氧化钡到溶液呈中性:Ba2++H++OH-+SO42-═BaSO4↓+H2O | |
| D. | 氢氧化钠溶液中吸收少量二氧化硫:2OH-+SO2═SO32-+H2O |
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
(2)写出Cr3+的电子排布式[Ar]3d3 ;元素周期表分为五个区域,Ga属于p区元素.
(3)Fe3+的化学性质比Fe2+稳定,其原因是Fe3+的3d轨道为半充满状态.
(4)前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有5种.
(5)试比较:第一电离能I1(K)<I1(Ca)(填“>”、“<”或“=”).
 砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.
砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长.
 甲烷在一定条件下可生成以下微粒:
甲烷在一定条件下可生成以下微粒:
 .
.