题目内容
9.实验室化学科学的基础,在实验室中不慎受碱腐蚀时,可先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液冲洗;硼酸是一种比碳酸更弱的酸,在滴眼液、杀虫剂等中也常有应用.某合作学习小组的同学拟用硼砂制取硼酸并测定硼酸样品的纯度.制备硼酸的实验流程如图: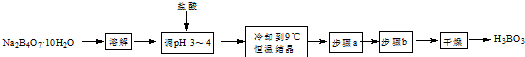
(1)溶解硼砂时需要的玻璃仪器有:烧杯和玻璃棒.
(2)用pH试纸测定溶液pH的操作方法为用干燥洁净的玻璃棒蘸取待测溶液点在试纸中央,半分钟内与标准比色卡进行对照,判断溶液的pH.
(3)用盐酸酸化硼砂溶液生成硼酸的离子方程式为B4O72-+2H++5H2O=4H3BO3.
(4)实验流程中缺少的步骤a、步骤b操作分别为过滤、洗涤.
(5)硼酸酸性太弱不能用碱的标准溶液直接滴定,实验室常采用间接滴定法,其原理为:
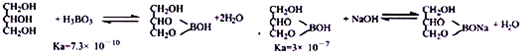
滴定步骤为:
准确称取0.3000g样品→锥形瓶$→_{25mL}^{中性甘油}$$→_{溶解}^{加热}$冷却$\stackrel{滴入1-2滴酚酞}{→}$$→_{滴定}^{0.2000mol•L-1NaOH溶液}$滴定终点
①滴定到终点时溶液颜色变化是由无色变为浅红色.
②若滴定到终点时消耗NaOH标准溶液22.00mL,则本次滴定测得的硼酸样品中硼酸的质量分数为90.93%(假定杂质不反应).
③若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,将导致测得的结果偏大.(选填:“偏大”、“偏小”或“不变”).
分析 用硼砂制取硼酸并测定硼酸样品的纯度,硼砂溶解后加入盐酸调节溶液PH为3-4,冷却到9°C,恒温结晶,过滤洗涤干燥得到硼酸,
(1)固体溶解需要烧杯和玻璃棒;
(2)pH试纸测定溶液pH的操作方法是用干燥洁净的玻璃棒蘸取待测溶液点在试纸中央,半分钟内与标准比色卡进行对照得到溶液PH;
(3)用盐酸酸化硼砂溶液生成硼酸反应为:B4O72-+2H++5H2O=4H3BO3;
(4)依据上述分析可知操作步骤是过滤洗涤;
(5)①滴定过程中加入的指示剂是酚酞溶液,滴入氢氧化钠溶液到反应终点,溶液颜色由无色变化为浅红色证明反应达到终点;
②分析滴定原理和反应的定量关系计算;
③若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,则消耗标准溶液体积增大,依据c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,测定结果偏大.
解答 解:用硼砂制取硼酸并测定硼酸样品的纯度,硼砂溶解后加入盐酸调节溶液PH为3-4,冷却到9°C,恒温结晶,过滤洗涤干燥得到硼酸;
(1)固体溶解需要烧杯和玻璃棒,溶解硼砂时需要的玻璃仪器有:烧杯和玻璃棒;
故答案为:玻璃棒;
(2)pH试纸测定溶液pH的操作方法是用干燥洁净的玻璃棒蘸取待测溶液点在试纸中央,半分钟内与标准比色卡进行对照得到溶液PH,用干燥洁净的玻璃棒蘸取待测溶液点在试纸中央,半分钟内与标准比色卡进行对照,判断溶液的pH;
故答案为:用干燥洁净的玻璃棒蘸取待测溶液点在试纸中央,半分钟内与标准比色卡进行对照,判断溶液的pH;
(3)硼砂中弱酸阴离子结合氢离子在溶液中生成硼酸,用盐酸酸化硼砂溶液生成硼酸反应的离子方程式为:B4O72-+2H++5H2O=4H3BO3;
故答案为:B4O72-+2H++5H2O=4H3BO3;
(4)依据上述分析可知实验流程中缺少的步骤a、步骤b操作分别为过滤、洗涤;
故答案为:过滤、洗涤;
(5)①分析流程可知,滴定过程中加入的指示剂是酚酞溶液,滴入氢氧化钠溶液到反应终点的现象为,滴入最后一滴溶液颜色由无色变化为浅红色且半分钟不变化,证明反应达到终点,滴定到终点时溶液颜色变化是由无色变为浅红色;
故答案为:由无色变为浅红色;
②分析滴定原理和反应的定量关系计算,实验室常采用间接滴定法,其原理为: ,
,
若滴定到终点时消耗NaOH标准溶液22.00mL,氢氧化钠溶液浓度为0.2000mol/L,
H3BO3~NaOH
1 1
n 0.0220L×0.2000mol/L
n=0.0044mol
则本次滴定测得的硼酸样品中硼酸的质量分数=$\frac{0.0044mol×62g/mol}{0.3000g}$×100%=90.93%;
故答案为:90.93%;
③若滴定时滴定管尖嘴部分有气泡,滴定过程中消失,则消耗标准溶液体积增大,测定结果偏大;
故答案为:偏大.
点评 本题考查了物质制备的流程分析判断,物质性质和实验过程判断,滴定实验的操作过程和计算应用,掌握基础是关键,题目难度中等.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案当为电池充电时,与外电源正极连接的电极上发生的反应是( )
| A. | NiO(OH) 2的氧化 | B. | NiO(OH)的还原 | C. | H2O的氧化 | D. | H2O的还原 |

已知:Ⅰ.SrCl2•6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.能否用新制氯水代替双氧水能(填“能”或“否”).
(3)在步骤②-③的过程中,将溶液的pH值由1调节至B;宜用的试剂为EG.
A.1.5 B.4 C.9.7
D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体 G.氧化锶粉末
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4(填化学式).
(5)工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是温度高有利于除去湿存(晶体表面附着的)水,但温度高于61℃时,氯化锶晶体中的结晶水也会失去.
(6)步骤⑥中,洗涤氯化锶晶体最好选用D.
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液.
| 序号 | 物质 | 杂质 | 除杂试剂或操作方法 |
| ① | NaCl溶液 | Na2CO3 | 加入盐酸,蒸发 |
| ② | FeSO4溶液 | CuSO4 | 加入过量铁粉并过滤 |
| ③ | H2 | CO2 | 依次通过盛有NaOH溶液和浓硫酸的洗气瓶 |
| ④ | NaNO3 | CaCO3 | 加稀盐酸溶解、过滤、蒸发、结晶 |
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ①②③④ |
| 元素代号 | A | B | C | D | E | F | G |
| 原子半径/nm | 0.037 | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | -1 | -2 | +5、-3 |
(2)B的原子结构示意图为
 ;
;(3)D、E气态氢化物的稳定性强弱顺序为H2S<HCl(填化学式);
(4)上述七种元素的最高价氧化物对应水化物中酸性最强的是HClO4(填化学式);
(5)以C为材料制成的容器不能贮存强碱溶液,用离子方程式表示其原因为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(6)碲(52Te)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下发生化学或物理的性能改变而记录、储存信号.推测碲元素在周期表中的位置,则碲元素及其化合物可能具有的性质为:ACD;
A.单质碲在常温下是固体 B.Cl2通入H2Te溶液中不发生反应
C.H2Te不如HI稳定 D.H2TeO4的酸性比H2SO4的弱
(7)液态GA3的电离方式与液态A2F类似,则液态GA3的电离方程式为2NH3(l)
 NH4++NH2-.
NH4++NH2-. | 杂质 | 加入试剂 | 化学方程式 |
| 硫酸盐 | ||
| MgCl2 | ||
| CaCl2 |
 ;AB2的结构式是O=C=O.
;AB2的结构式是O=C=O.