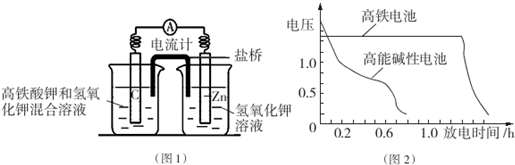
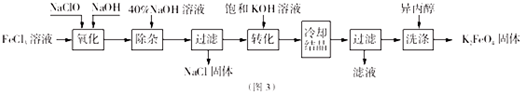
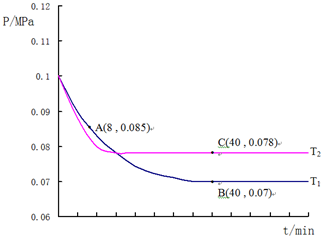
题目内容
2.W、X、Y是短周期中的三种常见元素,其原子序数依次增大.W、Y的氧化物是导致酸雨的主要物质,X的基态原子核外有7个原子轨道填充了电子.(1)W位于元素周期表第二周期第VA族.W的气态氢化物稳定H2O(g)弱(填“强”或“弱”).
(2)Y的基态原子核外电子排布式是1s22s22p63s23p4,Y的第一电离能X大(填“大”或“小”).
(3)已知:
Fe(s)+$\frac{1}{2}$O2(g)=FeO(s)△H=-272.0kJ•mol-1
2X(s)+$\frac{3}{2}$O2(g)=X2O3(s)△H=-1675.7kJ•mol-1
则:X的单质和FeO反应的热化学方程式是3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7KJ/mol.
分析 W、X、Y是短周期中的三种常见元素,其原子序数依次增大,导致酸雨的主要物质是二氧化氮和二氧化硫,Y的原子序数大于W的,所以W是氮元素,Y是硫元素;X的基态原子核外有7个原子轨道填充了电子,且原子序数大于W,而小于Y,核外电子排布为1s22s22p63s23p1,所以X是铝元素,据此解答.
解答 解:W、X、Y是短周期中的三种常见元素,其原子序数依次增大,导致酸雨的主要物质是二氧化氮和二氧化硫,Y的原子序数大于W的,所以W是氮元素,Y是硫元素;X的基态原子核外有7个原子轨道填充了电子,且原子序数大于W,而小于Y,核外电子排布为1s22s22p63s23p1,所以X是铝元素.
(1)W为N元素,处于周期表中第二周期ⅤA族,N的气态氢化物是NH3,由于非金属性N<O,NH3稳定性比H2O弱,
故答案为:二;ⅤA;弱;
(2)Y为硫元素,硫原子核外电子数为16,基态核外电子排布式为:1s22s22p63s23p4,同周期随原子序数增大元素第一电离能呈增大趋势,其第一电离能比Al的大,
故答案为:1s22s22p63s23p4;大;
(3)已知:①、Fe(s)+$\frac{1}{2}$O2(g)=FeO(s)△H=-272.0kJ•mol-1
②、2Al(s)+$\frac{3}{2}$O2(g)=Al2O3(s)△H=-1675.7kJ•mol-1
根据盖斯定律,②-①×3可得:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7KJ/mol
故答案为:3FeO(s)+2Al(s)=Al2O3(s)+3Fe(s)△H=-859.7KJ/mol.
点评 本题以元素推断为载体,考查结构与位置关系、核外电子排布、电离能、热化学方程式等知识点,能正确判断各元素是解本题的关键,书写基态原子核外电子排布式要遵循构造原理,掌握利用盖斯定律计算反应热或实现热化学方程式.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案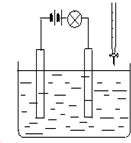 在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )
在电解质溶液的导电性装置(如图所示)中,若向某一电解质溶液中逐滴加入另一溶液时,则灯泡由亮变暗,至熄灭后又逐渐变亮的是( )| A. | 盐酸中逐滴加入食盐溶液 | B. | 硫酸中逐滴加入氢氧化钠溶液 | ||
| C. | 硫酸中逐滴加入氢氧化钡溶液 | D. | 醋酸中逐渐加入氢氧化钠溶液 |

已知:Ⅰ.SrCl2•6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水.
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH如表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 |
| 沉淀完全的pH | 3.7 | 9.7 |
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为2Fe2++H2O2+2H+=2Fe3++2H2O.能否用新制氯水代替双氧水能(填“能”或“否”).
(3)在步骤②-③的过程中,将溶液的pH值由1调节至B;宜用的试剂为EG.
A.1.5 B.4 C.9.7
D.氨水 E.氢氧化锶粉末 F.碳酸钠晶体 G.氧化锶粉末
(4)操作③中所得滤渣的主要成分是Fe(OH)3、BaSO4(填化学式).
(5)工业上用50~60℃热风吹干六水氯化锶,选择该温度的原因是温度高有利于除去湿存(晶体表面附着的)水,但温度高于61℃时,氯化锶晶体中的结晶水也会失去.
(6)步骤⑥中,洗涤氯化锶晶体最好选用D.
A.水 B.稀硫酸 C.氢氧化钠溶液 D.氯化锶饱和溶液.
| A. | 2-甲基-3-己炔 | B. | 2-甲基丙烷 | C. | 3-甲基-2-丁烯 | D. | 2-甲基-2-丁烯 |