题目内容
19.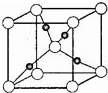 甲烷在一定条件下可生成以下微粒:
甲烷在一定条件下可生成以下微粒:A. 碳正离子(CH3+ ) B.碳负离子(CH3-)
C. 甲基 (-CH3) D.碳烯 (:CH2)
①四种微粒中,键角为120°的是A(填序号).
②碳负离子(CH3-)的空间构型为三角锥形,与CH3-互为等电子体的一种分子
是NH3(填化学式)
分析 ①根据价层电子对互斥理论确定中心原子杂化方式和微粒空间构型来判断;
②碳负离子(CH3-)含有3个σ键,1对孤电子对,从而确定分子构型;原子个数相等、价电子数相同的微粒互为等电子体.
解答 解:①A.碳正离子(CH3+)含有3个σ键,没有孤电子对,碳原子杂化方式是sp2,为平面三角形结构,键角为120°,故A正确;
B.碳负离子(CH3-)含有3个σ键,1对孤电子对,碳原子杂化方式是sp3,为三角锥形结构,键角为不是120°,故B错误;
C.甲基(-CH3)含有3个σ键,1个孤电子,碳原子杂化方式是sp3,为三角锥形结构,键角为不是120°,故C错误;
D.碳烯(:CH2)含有2个σ键,1对孤电子对,碳原子杂化方式是sp2,为平面三角形结构,由于孤电子对斥力大,键角为不是120°,故D错误;
故选A;
②碳负离子(CH3-)含有3个σ键,1对孤电子对,碳原子杂化方式是sp3,为三角锥形结构;CH3-原子个数为4、价电子数为8,则与CH3-互为等电子体的一种分子是NH3,故答案为:三角锥形;NH3.
点评 本题考查了微粒空间构型及原子杂化方式,根据价层电子对互斥理论来分析解答即可,难点的孤电子对个数的计算方法,为常考查点,要熟练掌握.

练习册系列答案
相关题目
7.下列四种烃的命名不正确的是( )
| A. | 2-甲基-3-己炔 | B. | 2-甲基丙烷 | C. | 3-甲基-2-丁烯 | D. | 2-甲基-2-丁烯 |
4.如图所示与对应的叙述一致的是( )
| A. |  在新型催化剂作用下利用太阳能使水分解的能量变化曲线 | |
| B. |  KNO3溶解度曲线,α点所示溶液为50℃时的不饱和溶液 | |
| C. |  常温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 | |
| D. |  10ml 0.01ml/L KMnO4酸性溶液与过量的0.1mol/L H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用) |
8.下列离子方程式中不正确的是( )
| A. | 氢氧化钡溶液与硫酸混合:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 铁粉与硝酸银溶液反应:Fe+2Ag+═Fe2++2Ag | |
| C. | 氯化铝溶液与过量的氨水反应:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| D. | 氯气通入冷的氢氧化钠溶液中:Cl2+2OH-═Cl-+ClO-+H2O |
9.下列离子方程式书写正确的是( )
| A. | 碳酸氢铵和足量的氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O | |
| B. | 三氯化铁溶液中通入硫化氢气体:2Fe3++H2S=2Fe2++S↓+2H+ | |
| C. | 用稀硝酸浸泡做过银镜反应的试管:Ag+2H++NO3-=Ag++NO2↑+H2O | |
| D. | 偏铝酸钠溶液中通入过量的二氧化碳气体:2AlO2-+CO2+2H2O=2Al(OH)3↓+CO32- |