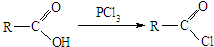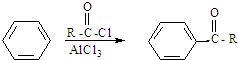题目内容
用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备难溶于水的碱式碳酸铜的流程如下:
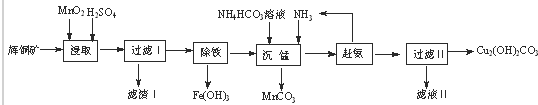
(1)下列措施是为加快浸取速率,其中无法达到目的是
A.延长浸取时间 B.将辉铜矿粉碎 C.充分搅拌 D.适当增加硫酸浓度
(2)浸取反应中氧化剂的化学式为 ;滤渣Ⅰ的成分为MnO2、S和 (写化学式);
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是 .
(4)“除铁”的方法是通过调节溶液PH,使Fe3+水解转化为Fe(OH)3,加入的试剂A可以是 (化学式);“赶氨”时,最适宜的操作方法 .
(5)“沉锰”(除Mn2+)过程中反应的离子方程式 .
(6)滤液Ⅱ经蒸发结晶得到的盐主要是 (写化学式).

(1)下列措施是为加快浸取速率,其中无法达到目的是
A.延长浸取时间 B.将辉铜矿粉碎 C.充分搅拌 D.适当增加硫酸浓度
(2)浸取反应中氧化剂的化学式为
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是
(4)“除铁”的方法是通过调节溶液PH,使Fe3+水解转化为Fe(OH)3,加入的试剂A可以是
(5)“沉锰”(除Mn2+)过程中反应的离子方程式
(6)滤液Ⅱ经蒸发结晶得到的盐主要是
考点:物质分离和提纯的方法和基本操作综合应用
专题:实验设计题
分析:辉铜矿主要成分为Cu2S,含少量Fe2O3、SiO2等杂质,加入稀硫酸和二氧化锰浸取,过滤得到滤渣为MnO2、SiO2、单质S,滤液中含有Fe3+、Mn2+、Cu2+,调节溶液PH除去铁离子,加入碳酸氢铵溶液沉淀锰过滤得到滤液赶出氨气循环使用,得到碱式碳酸铜,
(1)提高浸取速率,可增大浓度、升高温度、增大固体表面积或搅拌等;
(2)由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,根据方程式判断;
(3)浸取时氧化铜溶液稀硫酸生成硫酸铁和水,若先除铁再浸取,浸取速率明显变慢,Fe2O3在浸取时起媒介作用,Fe3+可催化Cu2S被MnO2氧化;
(4)加入的试剂A应用于调节溶液pH,促进铁离子的水解,但不能引入杂质,结合氨气易挥发的特点分析;
(5)“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,以此可书写反应的离子方程式;
(6)滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体.
(1)提高浸取速率,可增大浓度、升高温度、增大固体表面积或搅拌等;
(2)由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,根据方程式判断;
(3)浸取时氧化铜溶液稀硫酸生成硫酸铁和水,若先除铁再浸取,浸取速率明显变慢,Fe2O3在浸取时起媒介作用,Fe3+可催化Cu2S被MnO2氧化;
(4)加入的试剂A应用于调节溶液pH,促进铁离子的水解,但不能引入杂质,结合氨气易挥发的特点分析;
(5)“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,以此可书写反应的离子方程式;
(6)滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体.
解答:
解:(1)酸浸时,通过粉碎矿石或者升高温度或者进行搅拌都可以提高浸取率,延长浸取时间并不能提高速率,故答案为:A;
(2)由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,反应中Mn元素化合价降低,被还原,MnO2为氧化剂,因二氧化硅与酸不反应,则滤渣Ⅰ的成分为MnO2、S和SiO2,
故答案为:MnO2;SiO2;
(3)若先除铁再浸取,浸取速率明显变慢,Fe2O3在浸取时起媒介作用,Fe3+可催化Cu2S被MnO2氧化,
故答案为:Fe3+可催化Cu2S被MnO2氧化;
(4)加入的试剂A应用于调节溶液pH,促进铁离子的水解,但不能引入杂质,因最后要制备碱式碳酸铜,则可加入氧化铜、氢氧化铜等,因氨气易挥发,加热可促进挥发,则可用加热的方法.
故答案为:CuO或Cu(OH)2;加热;
(5)“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,反应的离子方程式为Mn2++HCO3-+NH3?H2O=MnCO3↓+NH4++H2O,
故答案为:Mn2++HCO3-+NH3?H2O=MnCO3↓+NH4++H2O;
(6)滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体,故答案为:(NH4)2SO4.
(2)由滤渣1的成份可知反应的化学方程式是:2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O,反应中Mn元素化合价降低,被还原,MnO2为氧化剂,因二氧化硅与酸不反应,则滤渣Ⅰ的成分为MnO2、S和SiO2,
故答案为:MnO2;SiO2;
(3)若先除铁再浸取,浸取速率明显变慢,Fe2O3在浸取时起媒介作用,Fe3+可催化Cu2S被MnO2氧化,
故答案为:Fe3+可催化Cu2S被MnO2氧化;
(4)加入的试剂A应用于调节溶液pH,促进铁离子的水解,但不能引入杂质,因最后要制备碱式碳酸铜,则可加入氧化铜、氢氧化铜等,因氨气易挥发,加热可促进挥发,则可用加热的方法.
故答案为:CuO或Cu(OH)2;加热;
(5)“沉锰”(除Mn2+)过程中,加入碳酸氢铵和氨气,生成碳酸锰沉淀,反应的离子方程式为Mn2++HCO3-+NH3?H2O=MnCO3↓+NH4++H2O,
故答案为:Mn2++HCO3-+NH3?H2O=MnCO3↓+NH4++H2O;
(6)滤液Ⅱ主要是硫酸铵溶液通过蒸发浓缩,冷却结晶,过滤洗涤得到硫酸铵晶体,故答案为:(NH4)2SO4.
点评:本题考查了物质分离提纯的方法和流程分析应用,为高频考点,侧重于学生的分析能力和实验能力的考查,解答该类题目,注意把握实验原理和操作流程的目的,主要是物质性质的理解,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列说法正确的是( )
A、根据反应Cu+H2SO4
| ||||
| B、电解含Pb(NO3)2和Cu(NO3)2的溶液,阴极上阳离子得电子次顺依次是Cu2+、H+、Pb2+ | ||||
| C、含amolNa2S的溶液最多能吸收2.5amol的二氧化硫气体 | ||||
| D、因Cl2的氧化性强于I2的氧化性,所以置换反应I2+2NaClO3═2NaIO3+Cl2不能发生 |
根据如图示判断下列叙述符合事实的是( )
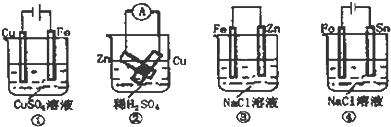

| A、按图①连接并放置一段时间后,Fe片表面会“镀”上一层铜 |
| B、按图②连接好导线后(Zn片与Cu片相接触),灵敏电流表会发生非常明显的偏转 |
| C、按图③连接并放置片刻,在Fe片附近加一滴KSCN溶液,溶液变为深红色 |
| D、按图④连接并放置一段时间后,在Sn片上有无色气泡聚集 |
实验室使用pH传感器来测定Na2CO3和NaHCO3混合物中NaHCO3的含量.称取1.59g 样品,溶于水配成250.00ml溶液,取出该溶液25.00ml用 0.1mol?L-1 盐酸进行滴定,得到如下曲线.以下说法或操作正确的是( )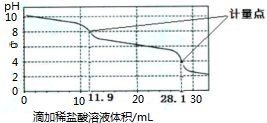

| A、上一个计量点前发生反应的离子方程式为HCO3-+H+═H2O+CO2↑ |
| B、下一个计量点溶液中存在大量的阴离子是Cl-、HCO3- |
| C、此样品n(NaHCO3)=(28.1-2×11.9)×10-3 mol |
| D、使用该方法测定Na2CO3和NaOH混合溶液中的氢氧化钠含量,将会得到1个计量点 |
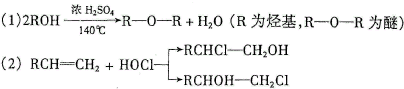

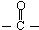 )的化合物反应生成醇,其过程可表示如下:
)的化合物反应生成醇,其过程可表示如下: (-R1、-R2表示烃基)
(-R1、-R2表示烃基)