题目内容
11.在生活与化学实验中,常常发生离子反应,请按要求填空.Ⅰ.人的胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3)能治疗胃酸过多,请写出其反应的离子方程式:HCO3-+H+=CO2↑+H2O;如果病人同时患胃溃疡,为防胃壁穿孔,不能服用小苏打,此时最好用含氢氧化铝的胃药(如胃舒平),请写出反应的离子方程式:Al(OH)3+3H+=Al3++3H2O.
Ⅱ.有一包白色粉末,其中可能含有Ba(NO3)2、MgCl2、K2CO3、NaOH,现做以下实验:
①取一定量粉末加入水中,振荡,有白色沉淀生成;
②向①的沉淀物中加入足量稀硝酸,白色沉淀完全消失,没有气泡产生;
③向①的上层清液中滴入稀硫酸,有白色沉淀产生.
根据上述实验事实,回答下列问题:
(1)原白色粉末中一定含有的物质是Ba(NO3)2、MgCl2、NaOH,一定不含有的物质是K2CO3.(写化学式)
(2)写出各步变化的离子方程式.
①Mg2++2OH-=Mg(OH)2↓;②Mg(OH)2+2H+=Mg2++2H2O;③Ba2++SO42-=BaSO4↓.
分析 I.小苏打(NaHCO3)能治疗胃酸过多,反应生成氯化钠、水、二氧化碳;含氢氧化铝的胃药与胃酸反应生成氯化铝和水;
Ⅱ.①取一定量粉末加入水中,振荡,有白色沉淀生成,则白色沉淀为碳酸钡或氢氧化镁;
②向①的沉淀物中加入足量稀硝酸,白色沉淀完全消失,没有气泡产生,可知白色沉淀只能为氢氧化镁,则一定含MgCl2、NaOH,一定不含K2CO3;
③向①的上层清液中滴入稀硫酸,有白色沉淀产生,白色沉淀为硫酸钡,则一定含Ba(NO3)2,以此来解答.
解答 解:Ⅰ.小苏打(NaHCO3)能治疗胃酸过多,反应生成氯化钠、水、二氧化碳,离子反应为HCO3-+H+=CO2↑+H2O;含氢氧化铝的胃药与胃酸反应生成氯化铝和水,离子反应为Al(OH)3+3H+=Al3++3H2O,
故答案为:HCO3-+H+=CO2↑+H2O;Al(OH)3+3H+=Al3++3H2O;
Ⅱ.①取一定量粉末加入水中,振荡,有白色沉淀生成,则白色沉淀为碳酸钡或氢氧化镁;
②向①的沉淀物中加入足量稀硝酸,白色沉淀完全消失,没有气泡产生,可知白色沉淀只能为氢氧化镁,则一定含MgCl2、NaOH,一定不含K2CO3;
③向①的上层清液中滴入稀硫酸,有白色沉淀产生,白色沉淀为硫酸钡,则一定含Ba(NO3)2,
(1)原白色粉末中一定含有的物质是Ba(NO3)2、MgCl2、NaOH;一定不含有的物质为K2CO3,
故答案为:Ba(NO3)2、MgCl2、NaOH;K2CO3;
(2)发生的离子反应分别为①Mg2++2OH-=Mg(OH)2↓、②Mg(OH) 2+2H+=Mg2++2H2O、③Ba2++SO42-=BaSO4↓,
故答案为:Mg2++2OH-=Mg(OH)2↓;Mg(OH) 2+2H+=Mg2++2H2O;Ba2++SO42-=BaSO4↓.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应及白色沉淀的判断为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,题目难度不大.

 孟建平名校考卷系列答案
孟建平名校考卷系列答案| A. | 为了加快过滤速度,可用玻璃棒搅拌过滤器中的液体 | |
| B. | 在蒸馏时应先打开冷凝水开关,待水充满后再点燃酒精灯 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,然后换一个烧杯将上层液体放出 | |
| D. | 在做蒸馏实验时应将温度计的水银球浸没在液体里 |
常温下,1mol化学键分解成气态原子所需要的能量用E表示。根据表中信息判断下列说法不正确的是( )
共价键 | H—H | F—F | H—F | H—Cl | H—I |
E/(kJ·mol-1) | 436 | 157 | 568 | 432 | 298 |
A.432kJ·mol-1>E(H—Br)>298kJ·mol-1
B.表中最稳定的共价键是H—F键
C.H2(g)→2H(g)△H=+436kJ·mol-1
D.H2(g)+F2(g)=2HF(g)△H=-25kJ·mol-1
(1)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO,3.0mol H2O,1.0mol CO2和x mol H2,则:
①当x=5.0时,上述平衡向逆反应(填“正反应”或“逆反应”)方向移动.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是0≤x<3.
(2)已知在一定温度下:
C(s)+CO2(g)?2CO (g) 平衡常数K1;
C(s)+H2O(g)?CO(g)+H2(g) 平衡常数K2;
CO(g)+H2O(g)?H2(g)+CO2(g) 平衡常数K;
则K1、K2、K之间的关系是K=$\frac{{K}_{2}}{{K}_{1}}$.
(3)某催化反应室中发生的反应为:
CH4(g)+H2O(g)═CO(g)+3H2(g)△H1=+216kJ•mol-1
CH4(g)+CO2(g)═2CO(g)+2H2(g)△H2
已知CO(g)+H2O(g)═CO2(g)+H2(g)△H3=-44kJ•mol-1,则△H2=+260 kJ•mol-1.
(4)某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如表:
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
②实验结果表明,催化剂的催化效果与催化剂接触面积 有关.
| A. | O2的摩尔质量是32g | B. | 氯化钠的相对原子质量是58.5g | ||
| C. | 1molH2O的质量是18g | D. | 1molH2O含有氢原子的个数2个 |
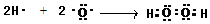 ;在微电子工业中,氨气的水溶液可用作刻蚀剂Y的清除剂,反应产物不污染环境,其化学方程式为2NH3?H2O+3H2O2=N2+8H2O或2NH3+3H2O2=N2+6H2O.
;在微电子工业中,氨气的水溶液可用作刻蚀剂Y的清除剂,反应产物不污染环境,其化学方程式为2NH3?H2O+3H2O2=N2+8H2O或2NH3+3H2O2=N2+6H2O. 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新生活方式.