题目内容
要除去MgCl2酸性溶液中少量的FeCl3,不宜选用的试剂是 ( )
A.MgO B.MgCO3 C.NaOH D.Mg(OH)2
练习册系列答案
相关题目
5.厨房中的化学知识很多,下面是有关厨房中的常见操作或者常见现象,其中不属于氧化还原反应的是( )
| A. | 用食醋清洗热水瓶中的水垢【主要成分是CaCO3和Mg(OH)2】 | |
| B. | 用煤气灶燃烧天然气为炒菜提供热量 | |
| C. | 烧菜用过的铁锅,经放置常出现红棕色斑迹 | |
| D. | 牛奶久置变质腐败 |
某学生用0.20mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作如下:
① 用蒸馏水洗涤碱式滴定管,并立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 移取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上步骤有错误的是(填编号) ,该错误操作会导致测定结果(填“偏大”、“偏小”或“无影响”) 。
(2)若移取20.00mL待测液注入有水的锥形瓶中,会导致结果(填“偏大”、“偏小”或“无影响”) 。
(3)判断滴定终点的现象是: 。

(4)如图是某次滴定时的滴定管中的液面,其读数为 mL。
(5)根据下列数据:
滴定次数 | 待测体积(mL) | 标准烧碱体积(mL) | |
滴定前读数 | 滴定后读数 | ||
第一次 | 20.00 | 0.40 | 20.40 |
第二次 | 20.00 | 0.00 | 22.60 |
第三次 | 20.00 | 4.00 | 24.00 |
请计算待测盐酸溶液的浓度: mol/L。
6.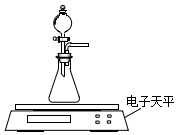 碳酸钙、盐酸是中学化学实验中的常用试剂.
碳酸钙、盐酸是中学化学实验中的常用试剂.
(1)甲同学拟测定CaCO3固体与过量0.1mol•L-1 HCl的反应速率.
①该反应的离子方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
②设计实验方案:通过测量生成二氧化碳的体积和反应时间或消耗碳酸钙固体的质量和反应时间计算反应速率
(2)乙同学拟用如图装置探究固体表面积和反应物浓度对化学反应速率的影响.电子天平限选试剂与用品:0.1mol•L-1 HCl、颗粒状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
(i)设计实验方案:在反应物浓度或固体表面积不同的条件下,测定生成等质量二氧化碳所需时间
(要求所测得的数据能直接体现反应速率大小).
(ⅱ) 根据(i)中设计的实验测定方案,拟定实验表格,完整体现实验方案.列出所用试剂的用量、待测物理量;数据用字母a、b、c、d表示.
已知实验1和2探究固体表面积对反应速率的影响;
实验1和3探究反应物浓度对反应速率的影响.
写出表中①-⑥所代表的必要数据或物理量
 碳酸钙、盐酸是中学化学实验中的常用试剂.
碳酸钙、盐酸是中学化学实验中的常用试剂.(1)甲同学拟测定CaCO3固体与过量0.1mol•L-1 HCl的反应速率.
①该反应的离子方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
②设计实验方案:通过测量生成二氧化碳的体积和反应时间或消耗碳酸钙固体的质量和反应时间计算反应速率
(2)乙同学拟用如图装置探究固体表面积和反应物浓度对化学反应速率的影响.电子天平限选试剂与用品:0.1mol•L-1 HCl、颗粒状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
(i)设计实验方案:在反应物浓度或固体表面积不同的条件下,测定生成等质量二氧化碳所需时间
(要求所测得的数据能直接体现反应速率大小).
(ⅱ) 根据(i)中设计的实验测定方案,拟定实验表格,完整体现实验方案.列出所用试剂的用量、待测物理量;数据用字母a、b、c、d表示.
已知实验1和2探究固体表面积对反应速率的影响;
实验1和3探究反应物浓度对反应速率的影响.
写出表中①-⑥所代表的必要数据或物理量
| 物理量 实验序号 | V(0.1mol•L-1 HCl)/mL | m(颗粒状CaCO3)/g | m(粉末状CaCO3)/g | V(蒸馏水)/mL | ⑤ | ⑥ |
| 实验1 | a | b | 0 | c | d | |
| 实验2 | ① | 0 | ③ | c | d | |
| 实验3 | c | ② | 0 | ④ | d |


 .1molH2SO4中含1molH2 D.1molH2O的质量是18g
.1molH2SO4中含1molH2 D.1molH2O的质量是18g (1)某容器中发生了一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种粒子,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.
(1)某容器中发生了一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种粒子,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.