题目内容
17. 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新生活方式.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是一种理想,更是一种值得期待的新生活方式.(1)将CO2与焦炭作用生成CO,CO可用于炼铁等.
①已知:C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ/mol
Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol
则CO还原Fe2O3的热化学方程式为Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氯化钯(PdCl2)溶液常被应用于检测空气中微量CO.PdCl2被还原成单质,反应的化学方程式为PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)将两个石墨电极插入KOH溶液中,向两极分别通入C3H8和O2构成丙烷燃料电池.
①负极电极反应式是C3H8 +26OH--20e-=3CO32-+17H2O;
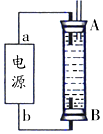
②某同学利用丙烷燃料电池设计了一种电解法制取Fe(OH)2的实验装置(如图所示),通电后,溶液中产生大量的白色沉淀,且较长时间不变色.下列说法中正确的是ABD.(填序号)
A.电源中的a为正极,b为负极
B.可以用NaCl溶液作为电解液
C.A、B两端都必须用铁作电极
D.阴极发生的反应是:2H++2e-=H2↑
分析 (1)①根据盖斯定律,由已知热化学方乘以适当的系数进行加减构造目标热化学方程式,反应热也乘以相应的系数并进行相应的加减,据此计算;
②根据氧化还原反应规律,CO与PdCl2溶液反应,PdCl2被还原成单质,则CO被氧化成CO2,根据质量守恒定律,有水参与反应同时生成氯化氢,据此写出反应的化学方程式即可;
(2)①根据C3H8和O2构成丙烷燃料电池的总反应:C3H8+5O2+6OH-=3CO32-+7H2O,正极发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-,而负极电极反应式=总反应方程式-正极的电极反应式来解答;
②A、B端析出氢气可驱赶原溶液中溶解的少量氧气;
B、电解液选用NaCl溶液不影响实验,因为阳极是铁失电子生成亚铁离子,溶液中的阴离子不放电;
C、阳极应该用铁电极,阴极用惰性电极亦可;
D、B电极反应是阴极氢离子放电生成氢气.
解答 解:(1)①Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g)△H1=+489.0kJ/mol ①
C(石墨)+CO2(g)=2CO(g)△H2=+172.5kJ/mol ②
由①-②×3,得到热化学方程式:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol,
故答案为:Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-28.5kJ/mol;
②氧化还原反应规律,CO与PdCl2溶液反应,PdCl2被还原成单质,则CO被氧化成CO2,根据质量守恒定律,有水参与反应同时生成氯化氢,反应的化学方程式为:PdCl2+CO+H2O=Pd+CO2+2HCl,
故答案为:PdCl2+CO+H2O=Pd+CO2+2HCl;
(2)①C3H8和O2构成丙烷燃料电池的总反应:C3H8+5O2+6OH-=3CO32-+7H2O,正极发生还原反应,电极反应式为:O2+4e-+2H2O=4OH-,负极发生氧化反应,电极反应式为:C3H8 +26OH--20e-=3CO32-+17H2O,
故答案为:C3H8 +26OH--20e-=3CO32-+17H2O;
②A、因为生成的氢气将装置中原有氧气溢出,所以氢气从B端阴极析出,A电极则是铁做阳极失去电子生成亚铁离子,电源中的a与A相连,则a为正极,b与B相连,则b为负极,故A正确;
B、电解池中阳极是铁失去电子发生氧化反应生成亚铁离子,阴极是溶液中的氢离子得电子发生还原反应,所以电解质溶液中的阴离子不会在阳极失电子,所以选用NaCl溶液不影响实验,故B正确;
C、阳极应该用铁电极,阴极可以是铁也可以是其他惰性电极,故C错误;
D、阴极氢离子放电,其电极反应为2H++2e-=H2↑,故D正确;
故答案为:ABD.
点评 本题考查热化学方程式、电极反应的书写,做题时注意把握影响平衡移动的因素、原电池、电解池原理和电极书写,题目难度中等.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案| A. | KSCN | B. | 氨水 | C. | 盐酸 | D. | NaOH |
 ,由分子式为C4H8的烯烃进行醛化反应,得到醛的同分异构体的数目为( )
,由分子式为C4H8的烯烃进行醛化反应,得到醛的同分异构体的数目为( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
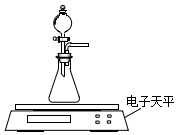 碳酸钙、盐酸是中学化学实验中的常用试剂.
碳酸钙、盐酸是中学化学实验中的常用试剂.(1)甲同学拟测定CaCO3固体与过量0.1mol•L-1 HCl的反应速率.
①该反应的离子方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
②设计实验方案:通过测量生成二氧化碳的体积和反应时间或消耗碳酸钙固体的质量和反应时间计算反应速率
(2)乙同学拟用如图装置探究固体表面积和反应物浓度对化学反应速率的影响.电子天平限选试剂与用品:0.1mol•L-1 HCl、颗粒状CaCO3、粉末状CaCO3、蒸馏水、量筒、秒表
(i)设计实验方案:在反应物浓度或固体表面积不同的条件下,测定生成等质量二氧化碳所需时间
(要求所测得的数据能直接体现反应速率大小).
(ⅱ) 根据(i)中设计的实验测定方案,拟定实验表格,完整体现实验方案.列出所用试剂的用量、待测物理量;数据用字母a、b、c、d表示.
已知实验1和2探究固体表面积对反应速率的影响;
实验1和3探究反应物浓度对反应速率的影响.
写出表中①-⑥所代表的必要数据或物理量
| 物理量 实验序号 | V(0.1mol•L-1 HCl)/mL | m(颗粒状CaCO3)/g | m(粉末状CaCO3)/g | V(蒸馏水)/mL | ⑤ | ⑥ |
| 实验1 | a | b | 0 | c | d | |
| 实验2 | ① | 0 | ③ | c | d | |
| 实验3 | c | ② | 0 | ④ | d |
 .1molH2SO4中含1molH2 D.1molH2O的质量是18g
.1molH2SO4中含1molH2 D.1molH2O的质量是18g (1)某容器中发生了一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种粒子,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.
(1)某容器中发生了一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种粒子,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示. .
.