题目内容
16.已知A、B、C、D、E、F都是短周期的主族元素,原子序数依次增大,其中A是宇宙中最丰富的元素,B的单质常温下为气体,C和E同主族,C和E可形成EC2和EC3两种分子,D是短周期中原子半径最大的元素.请回答下列问题:(1)①B在元素周期表中的位置第二周期第VA族;
②上述元素的最高价氧化物的水化物中酸性最强的是HClO4(写化学式).
(2)C、D、E、F四种元素对应的简单离子的半径由小到大的顺序是(用离子符号表示)Na+<O2-<Cl-<S2-.
(3)A和C可形成两种液态化合物X和Y,用电子武表示原子个数之比为1:1的物质Y的形成过程
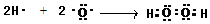 ;在微电子工业中,氨气的水溶液可用作刻蚀剂Y的清除剂,反应产物不污染环境,其化学方程式为2NH3?H2O+3H2O2=N2+8H2O或2NH3+3H2O2=N2+6H2O.
;在微电子工业中,氨气的水溶液可用作刻蚀剂Y的清除剂,反应产物不污染环境,其化学方程式为2NH3?H2O+3H2O2=N2+8H2O或2NH3+3H2O2=N2+6H2O.
分析 A、B、C、D、E、F都是短周期的主族元素,原子序数依次增大,其中A是宇宙中最丰富的元素,则A为H元素;C和E同主族,C和E可形成EC2和EC3两种分子,则C为O,E为S,F的原子序数增大,F只能为Cl,B的单质常温下为气体,B为N,D是短周期中原子半径最大的元素,D为Na元素,以此来解答.
解答 解:(1)①B为N元素,位于第二周期第VA族,故答案为:第二周期第VA族;
②高氯酸为所有含氧酸中酸性最强的酸,则上述元素的最高价氧化物的水化物中酸性最强的是HClO4,故答案为:HClO4;
(2)电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则离子半径为Na+<O2-<Cl-<S2-,
故答案为:Na+<O2-<Cl-<S2-;
(3)A为H,C为O,用电子武表示原子个数之比为1:1的物质Y的形成过程为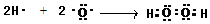 ;氨气的水溶液可用作刻蚀剂Y的清除剂,反应产物不污染环境,生成氮气和水,其化学方程式为2NH3?H2O+3H2O2=N2+8H2O 或2NH3+3H2O2=N2+6H2O,
;氨气的水溶液可用作刻蚀剂Y的清除剂,反应产物不污染环境,生成氮气和水,其化学方程式为2NH3?H2O+3H2O2=N2+8H2O 或2NH3+3H2O2=N2+6H2O,
故答案为: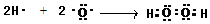 ;2NH3?H2O+3H2O2=N2+8H2O 或2NH3+3H2O2=N2+6H2O.
;2NH3?H2O+3H2O2=N2+8H2O 或2NH3+3H2O2=N2+6H2O.
点评 本题考查位置、结构与性质,为高频考点,把握原子结构、元素的性质、元素的位置推断元素为解答的关键,侧重分析与推断能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.热化学方程式及盖斯定律应用较广,根据下列信息完成下列各题:
(1)在298K、100kPa时,已知:2H2O(g)=O2(g)+2H2(g)△H1
Cl2(g)+H2(g)=2HCl(g)△H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系为△H1=△H3-2△H2.
(2)根据下列反应的能量变化示意图(图1),2C(s)+O2(g)?2CO(g)△H=-221.0kJ/mol.
(3)N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成的氮气和气态水时,放出133.5kJ热量,则N2H4燃烧的热化学方程式是N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534 kJ/mol.
(4)已知1g氢气完全燃烧生成气态水时放出热量143kJ,根据下列相关数据,则表中x为199.
(5)科学家开发出了利用太阳能分解水的新型催化剂.下列有关水分解过程的能量变化示意图(图2)正确的是B

(6)已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6KJ•mol-1 ,CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ•mol-1,现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比约为1:3.
(7)已知测定中和热的实验装置如图3所示.稀硫酸和稀氢氧化钠溶液反应的中和热△H=-57.3kJ/mol,若用同浓度稀醋酸溶液代替上述硫酸测定中和热,所得数据△H偏大.(填“偏大”或“偏小”或“不变”)
(1)在298K、100kPa时,已知:2H2O(g)=O2(g)+2H2(g)△H1
Cl2(g)+H2(g)=2HCl(g)△H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系为△H1=△H3-2△H2.
(2)根据下列反应的能量变化示意图(图1),2C(s)+O2(g)?2CO(g)△H=-221.0kJ/mol.
(3)N2H4是一种高效清洁的火箭燃料.0.25mol N2H4(g)完全燃烧生成的氮气和气态水时,放出133.5kJ热量,则N2H4燃烧的热化学方程式是N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=-534 kJ/mol.
(4)已知1g氢气完全燃烧生成气态水时放出热量143kJ,根据下列相关数据,则表中x为199.
| O═O | H-H | H-O(g) | ||
| 1mol化学键断裂时需要吸收的能量/kJ | 496 | 436 | x | |

(6)已知:2H2(g)+O2(g)=2H2O(l)△H=-571.6KJ•mol-1 ,CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890KJ•mol-1,现有H2与CH4的混合气体112L(标准状况),使其完全燃烧生成CO2和H2O(l),若实验测得反应放热3695KJ,则原混合气体中H2与CH4的物质的量之比约为1:3.
(7)已知测定中和热的实验装置如图3所示.稀硫酸和稀氢氧化钠溶液反应的中和热△H=-57.3kJ/mol,若用同浓度稀醋酸溶液代替上述硫酸测定中和热,所得数据△H偏大.(填“偏大”或“偏小”或“不变”)
2.含有其中离子的硫酸盐溶液:K+、Mg2+、Al3+、NH4+、Fe2+、Fe3+、Cu2+,可以将它们一一鉴别出来的一种试剂是( )
| A. | KSCN | B. | 氨水 | C. | 盐酸 | D. | NaOH |
3.下列应用或事实与胶体的性质无关的是( )
| A. | 清晨的阳光穿过茂密的林木枝叶所产生的美丽的光线 | |
| B. | 向FeCl3溶液中滴加NaOH溶液出现红褐色沉淀 | |
| C. | 肾功能衰竭等疾病引起的尿中毒,可利用半透膜进行血液透析 | |
| D. | 在海水与河水交界处,易形成三角洲 |
 (1)某容器中发生了一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种粒子,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.
(1)某容器中发生了一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种粒子,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.