题目内容
6.常温时,某溶液中由水电离出的H+和OH-的物质的量浓度的乘积为1×10-10,则该溶液可能是( )①H2SO4;②CH3COOH;③NH4Cl;④KOH ⑤CH3COONa.
| A. | ①④⑤ | B. | ③⑤ | C. | ①②③ | D. | ③ |
分析 常温下,某溶液中由水电离出的c(H+)与c(OH-)的乘积为10-10,c(H+)=c(OH-)=10-5mol/L,水的电离被促进.而酸、碱溶液对水的电离起到抑制作用,水解的盐对水的电离起到促进作用.据此分析.
解答 解:①H2SO4对水的电离有抑制作用,故①错误;
②CH3COOH是酸,对水的电离有抑制作用,故②错误;
③NH4Cl是强酸弱碱盐,在溶液中会水解,对水的电离有促进作用,故③正确;
④KOH是碱,对水的电离有抑制作用,故④错误;
⑤CH3COONa是强碱弱酸盐,在溶液中会水解,对水的电离有促进作用,故⑤正确.
故选B.
点评 本题考查了水电离平衡的影响因素分析判断,注意酸碱抑制水的电离,水解的盐促进水的电离,题目难度中等.

练习册系列答案
相关题目
1.下列两种气体的分子数一定相等的是( )
| A. | 质量相等、密度不同的N2和C2H4 | B. | 体积相等的CO和N2 | ||
| C. | 等温、等体积的O2和N2 | D. | 等压、等体积的N2和CH4 |
11.下列图示与对应的叙述相符的是( )


| A. | 图1表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化 | |
| B. | 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T1>T2 | |
| C. | 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 | |
| D. | 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s)?2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系 |
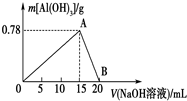 向20mL某物质的量浓度的AlCl3溶液中滴入2mol•L-1NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
向20mL某物质的量浓度的AlCl3溶液中滴入2mol•L-1NaOH溶液时,得到的Al(OH)3沉淀质量与所滴加的NaOH溶液的体积(mL)关系如图所示,试回答下列问题:

 ;②C物质苯环上一卤代物只有两种.
;②C物质苯环上一卤代物只有两种.
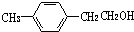 ,F的分子式C9H10.
,F的分子式C9H10.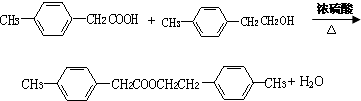 .
.