题目内容
14.写出C5H12的所有的同分异构体.分析 C5H12为烷烃,可利用减碳链的方法书写其同分异构体,以此来解答.
解答 解:C5H12为烷烃,由减碳链的方法可知其同分异构体有CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、(CH3)4C,共3种,
答:C5H12的所有的同分异构体为CH3CH2CH2CH2CH3、(CH3)2CHCH2CH3、(CH3)4C.
点评 本题考查烷烃同分异构体的书写,为基础性习题,把握减链法书写同分异构体为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
2. (1)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ/mol
(1)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ/mol
①下列描述中能说明上述反应已达平衡的是bd.
a.υ(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
②在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2半分钟后达到平衡,测得容器中含SO30.18mol,则υ(O2)=0.036mol•L-1•min-1;若继续通入0.4molSO2和0.2molO2则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.54mol<n(SO3)<0.6mol.
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)],反应的化学方程式为2NH3(g)+CO2(g)?CO(NH2)(1)+H2O(l),该反应的平衡常数和温度关系如下:
①△H< 0 (填“>”、“<”或“=”)
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)$\frac{{n(N{H_3})}}{{n(C{O_2})}}=x$,下图是氨碳比(x)与CO2平衡转化率(a)的关系.a随着x增大而增大的原因是NH3的量增大,平衡正向移动,则增大CO2的转化率.
(3)图中的B点处,NH3的平衡转化率为32%.
 (1)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ/mol
(1)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ/mol①下列描述中能说明上述反应已达平衡的是bd.
a.υ(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
②在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2半分钟后达到平衡,测得容器中含SO30.18mol,则υ(O2)=0.036mol•L-1•min-1;若继续通入0.4molSO2和0.2molO2则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.54mol<n(SO3)<0.6mol.
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)],反应的化学方程式为2NH3(g)+CO2(g)?CO(NH2)(1)+H2O(l),该反应的平衡常数和温度关系如下:
| T/°C | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)$\frac{{n(N{H_3})}}{{n(C{O_2})}}=x$,下图是氨碳比(x)与CO2平衡转化率(a)的关系.a随着x增大而增大的原因是NH3的量增大,平衡正向移动,则增大CO2的转化率.
(3)图中的B点处,NH3的平衡转化率为32%.
9.化学无处不在,下列与化学有关的说法,正确的是( )
| A. | 沱牌舍得酒标签注有“酒精度53%Vol”字样,它表示100g该白酒中含有53g,酒精 | |
| B. | 食盐可作调味剂,也可作食品防腐剂 | |
| C. | 碘是人体必须微量元素,所以要多吃富含高碘酸的食物 | |
| D. | “温室效应”、“酸雨”的形成都与氮氧化合物有关 |
6.常温时,某溶液中由水电离出的H+和OH-的物质的量浓度的乘积为1×10-10,则该溶液可能是( )
①H2SO4;②CH3COOH;③NH4Cl;④KOH ⑤CH3COONa.
①H2SO4;②CH3COOH;③NH4Cl;④KOH ⑤CH3COONa.
| A. | ①④⑤ | B. | ③⑤ | C. | ①②③ | D. | ③ |
3.下列各组物质中,化学键全部为共价键的是( )
| A. | NH4Cl CO2 Ne | B. | O2 KF SO2 | ||
| C. | HCl CH3CH2OH CH4 | D. | Na202 N2 H20 |
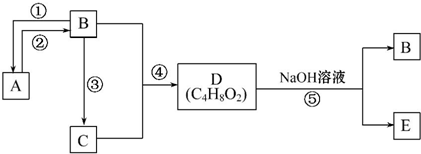
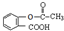 )是应用最广的解热镇痛药.通过乙二醇把阿斯匹林连接在高聚物E上,可制成缓释长效阿斯匹林.其合成过程如下:
)是应用最广的解热镇痛药.通过乙二醇把阿斯匹林连接在高聚物E上,可制成缓释长效阿斯匹林.其合成过程如下: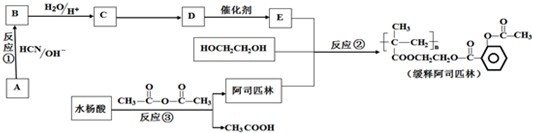
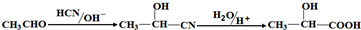
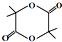 ;;聚合物
;;聚合物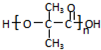 .
.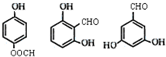 任意2种.
任意2种.