题目内容
17.教材中给出了Na2O2与H2O反应的化学方程式.为了探究Na2O2与H2O反应的机理,某学习探究小组在教师指导下设计了如图所示装置进行实验.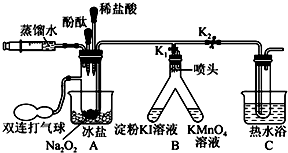
实验步骤如下:
①按图示组装仪器,并检查气密性为良好后装入药品;
②保持K1打开、K2关闭,将注射器中的水推入试管,此时A中无气体产生;
③挤压装有酚酞的胶头滴管,使酚酞滴入试管中,A中溶液显红色;
④挤压装有稀盐酸的胶头滴管,使酸液滴入试管中,红色消失后再滴加2滴;
⑤用双连打气球向A中鼓气,使A中溶液通过喷头进入B中支管,发现淀粉KI溶液变蓝,KMnO4溶液褪色;
⑥迅速打开止水夹K2,关闭K1,继续向A中鼓气,待A中溶液进入C中约三分之一时停止鼓气.然后用热水浴加热C片刻,C中有气泡冒出,经检验为氧气.
回答下列问题:
(1)写出Na2O2与H2O反应的离子方程式2Na2O2+2H2O═4Na++4OH-+O2↑.
(2)若向Na2O2中滴加适量的盐酸,也能产生使带火星的木条复燃的气体,且最后溶液呈中性,请写出该反应的化学方程式2Na2O2+4HCl═4NaCl+2H2O+O2↑.
(3)用离子方程式表示淀粉KI溶液变蓝的原因2I-+2H++H2O2=I2+2H2O.
(4)用离子方程式表示KMnO4溶液褪色的原因(MnO4-在酸性条件下被还原成Mn2+,不考虑MnO4-氧化Cl-)2MnO4-+5H2O2+6H+═2Mn2++5O2↑+8H2O.
(5)A中用冰盐冷浴和C中用热水浴的作用分别是防止生成的H2O2分解,促使H2O2分解.
(6)由此实验探究可知:Na2O2与H2O反应的机理是(用化学方程式表示)Na2O2+2H2O═2NaOH+H2O2,2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑.
分析 开始时试管中无气体生成,滴入酚酞后,溶液变红色,说明Na2O2与H2O反应生成了碱和H2O2,然后滴入的稀盐酸中和NaOH,H2O2在C中分解生成O2,
(1)Na2O2与H2O反应生成氢氧化钠和氧气;
(2)Na2O2中滴加适量的盐酸,也能产生使带火星的木条复燃的气体,且最后溶液呈中性,过氧化钠和盐酸反应生成氯化钠、氧气和水;
(3)H2O2有强氧化性,能将I-氧化成碘单质,所以淀粉碘化钾试纸变蓝,据此写出反应的离子方程式;
(4)H2O2使KMnO4溶液褪色,体现了双氧水的还原性,说明双氧水被酸性高锰酸钾溶液氧化成氧气;
(5)双氧水不稳定,温度过高容易分解,则A中用冰盐冷浴可防止温度过高H2O2分解,C中用热水浴可使加快H2O2分解;
(6)根据实验可知,过氧化钠与水反应的机理为:Na2O2与H2O反应生成H2O2,H2O2遇热分解生成氧气,据此写出反应方程式.
解答 解:开始时试管中无气体生成,滴入酚酞,溶液变红色,说明Na2O2与H2O反应生成了碱和H2O2,然后滴入的稀盐酸中和NaOH,H2O2在C中分解生成O2,
(1)Na2O2与H2O反应生成氢氧化钠和氧气,反应的离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑,
故答案为:2Na2O2+2H2O═4Na++4OH-+O2↑;
(2)Na2O2中滴加适量的盐酸,也能产生使带火星的木条复燃的气体,且最后溶液呈中性,过氧化钠和盐酸反应生成氯化钠、氧气和水,反应的化学方程式为:2Na2O2+4HCl═4NaCl+2H2O+O2↑,
故答案为:2Na2O2+4HCl═4NaCl+2H2O+O2↑;
(3)淀粉碘化钾试纸变蓝,说明H2O2有强氧化性,能将I-氧化成碘单质,反应的离子方程式为:2I-+2H++H2O2=I2+2H2O,
故答案为:2I-+2H++H2O2=I2+2H2O;
(4)酸性高锰酸钾溶液具有强氧化性,H2O2使KMnO4溶液褪色,体现了双氧水的还原性,反应的离子方程式为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O,
故答案为:2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O;
(5)双氧水不稳定,温度过高容易分解,则A中用冰盐冷浴,目的是防止温度过高H2O2分解;C中用热水浴可使H2O2分解,
故答案为:防止生成的H2O2分解,使H2O2分解;
(6)根据实验可知,过氧化钠与水反应的机理为:Na2O2与H2O反应生成H2O2,H2O2遇热分解生成氧气,反应方程式为:Na2O2+2H2O=2NaOH+H2O2、2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑,
故答案为:Na2O2+2H2O=2NaOH+H2O2、2H2O2$\frac{\underline{\;\;△\;\;}}{\;}$2H2O+O2↑.
点评 本题考查了探究过氧化钠与水的反应原理,题目难度中等,明确实验目的及双氧水的性质为解答关键,注意掌握过氧化钠与水反应的机理,试题侧重考查学生的分析、理解能力及化学实验能力.

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案| A. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液反应:SO${\;}_{4}^{2-}$+Ba2+═BaSO4↓ | |
| C. | 用氨水溶液氯化银沉淀:Ag++2NH3•H2O═[Ag(NH3)2]++2H20 | |
| D. | Fe(OH)3 溶于过量的HI溶液:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O |
| A. | CO2溶于水形成碳酸,SiO2难溶于水 | |
| B. | CO2通入Na2SiO3稀溶液中,生成白色胶状沉淀硅酸 | |
| C. | 高温下SiO2与碳酸盐反应生成CO2 | |
| D. | HCl通入可溶性碳酸盐溶液中放出气体,氯化氢通入可溶性硅酸盐溶液中生成沉淀 |
 (1)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ/mol
(1)接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:2SO2(g)+O2(g)?2SO3(g)△H=-190kJ/mol①下列描述中能说明上述反应已达平衡的是bd.
a.υ(O2)正=2v(SO3)逆
b.容器中气体的平均相对分子质量不随时间而变化
c.容器中气体的密度不随时间而变化
d.容器中气体的分子总数不随时间而变化
②在一个固定容积为5L的密闭容器中充入0.20molSO2和0.10molO2半分钟后达到平衡,测得容器中含SO30.18mol,则υ(O2)=0.036mol•L-1•min-1;若继续通入0.4molSO2和0.2molO2则平衡向正反应方向移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,0.54mol<n(SO3)<0.6mol.
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)],反应的化学方程式为2NH3(g)+CO2(g)?CO(NH2)(1)+H2O(l),该反应的平衡常数和温度关系如下:
| T/°C | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)$\frac{{n(N{H_3})}}{{n(C{O_2})}}=x$,下图是氨碳比(x)与CO2平衡转化率(a)的关系.a随着x增大而增大的原因是NH3的量增大,平衡正向移动,则增大CO2的转化率.
(3)图中的B点处,NH3的平衡转化率为32%.
| A. | 沱牌舍得酒标签注有“酒精度53%Vol”字样,它表示100g该白酒中含有53g,酒精 | |
| B. | 食盐可作调味剂,也可作食品防腐剂 | |
| C. | 碘是人体必须微量元素,所以要多吃富含高碘酸的食物 | |
| D. | “温室效应”、“酸雨”的形成都与氮氧化合物有关 |
 .
.