题目内容
1.下列两种气体的分子数一定相等的是( )| A. | 质量相等、密度不同的N2和C2H4 | B. | 体积相等的CO和N2 | ||
| C. | 等温、等体积的O2和N2 | D. | 等压、等体积的N2和CH4 |
分析 在相同温度和压强下,等体积的气体所含分子数目相等,可根据n=$\frac{m}{M}$=$\frac{V}{Vm}$=$\frac{N}{{N}_{A}}$或PV=nRT判断.
解答 解:A.N2和C2H4摩尔质量相等,则依据n=$\frac{m}{M}$可知,质量相等、密度不同的N2和C2H4,物质的量一定相等,则所含分子数相等,故A正确;
B.温度、压强未知,只有体积相等,不能确定一氧化碳和氮气的物质的量是否相等,则所含分子数不一定相等,故B错误;
C.只是温度和压强相等,压强是否相等不明确,则气体摩尔体积的数值是否相等不明确,故物质的量是否相等、分子数是否相等无法确定,故C错误;
D.只是体积和压强相等,温度是否相等不明确,则气体摩尔体积的数值是否相等不明确,故物质的量是否相等、分子数是否相等无法确定,故D错误;
故选:A.
点评 本题考查常用化学计量有关计算、阿伏伽德罗定律及推论等,注意根据pV=nRT理解阿伏伽德罗定律及讨论,注意阿伏伽德罗常数定律条件和使用对象,题目难度不大.

练习册系列答案
相关题目
9.化学无处不在,下列与化学有关的说法,正确的是( )
| A. | 沱牌舍得酒标签注有“酒精度53%Vol”字样,它表示100g该白酒中含有53g,酒精 | |
| B. | 食盐可作调味剂,也可作食品防腐剂 | |
| C. | 碘是人体必须微量元素,所以要多吃富含高碘酸的食物 | |
| D. | “温室效应”、“酸雨”的形成都与氮氧化合物有关 |
16.元素单质及其化合物有广泛用途,对于元素周期表中第3周期的元素来说,按原子序数递增的顺序(稀有气体除外),以下说法正确的是( )
| A. | 原子半径和离子半径均减小 | |
| B. | 金属性减弱,非金属性增强 | |
| C. | 氧化物对应的水化物碱性减弱,酸性增强 | |
| D. | 单质的熔点降低 |
6.常温时,某溶液中由水电离出的H+和OH-的物质的量浓度的乘积为1×10-10,则该溶液可能是( )
①H2SO4;②CH3COOH;③NH4Cl;④KOH ⑤CH3COONa.
①H2SO4;②CH3COOH;③NH4Cl;④KOH ⑤CH3COONa.
| A. | ①④⑤ | B. | ③⑤ | C. | ①②③ | D. | ③ |
13.温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据见表:
下列说法不正确的是( )
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50s的平均速率v(Cl2)=0.0016 mol•L-1•min-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol•L-1,则该反应的△H<0 | |
| C. | 温度为T时,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) | |
| D. | 温度为T时,起始时向容器中充入0.5 mol PCl3和0.5 mol Cl2,达到平衡时,PCl3的转化率小于80% |
10.下列反应,最终无沉淀产生的是( )
| A. | SO2通入盐酸酸化的硝酸钡溶液 | B. | 在AlCl3溶液中滴入过量的氨水 | ||
| C. | 在空气中长期存放的漂白粉溶液 | D. | 将少量NaAlO2投入盐酸中 |
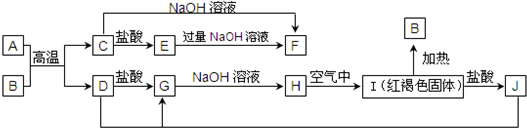
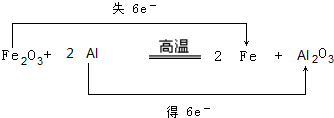 .
.

 .
.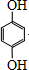 .
.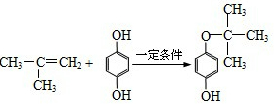 ,反应类型是加成反应.
,反应类型是加成反应.