题目内容
19.(1)碘元素在FeI3、Mg(IO2)2、KIO4、Fe(IO)3、X这五种化合物中显示的化合价有+1、+3、+5、+7、-1五种化合价,若化合物X为碘与钙、氧形成的化合物,则其化学式应是Ca(IO3)2
(2)元素X 的核电荷数为a,它的阳离子X m+与元素Y 的阴离子Y n-的电子层结构相同,则元素Y 的
核电荷数是a-m-n.
分析 (1)根据在化合物中正负化合价代数和为零结合化学式的书写方法进行分析;
(2)设元素Y的核电荷数是b,X失去m个电子后变为Xm+,Y得到n个电子后变为Yn-,二者电子层结构相同,即核外电子数相同,列出等式求解即可.
解答 解:(1)铁显+3价,镁显+2价,钾显+1价,氧显-2价,根据在化合物中正负化合价代数和为零可知,FeI3、Mg(IO2)2、KIO4、Fe(IO)3中碘元素的化合价分别为-1价,+3价,+7价,+1价,因此X中碘显+5价,又钙显+2价,因此碘与钙、氧形成的化合物的化学式应是Ca(IO3)2,故答案为:Ca(IO3)2;
(2)设元素Y的核电荷数是b,
因为X的核电荷数为a,它的阳离子Xm+,所以它的离子中带有(a-m)个电子,
因为阳离子Xm+与元素Y的阴离子Yn-电子层结构相同,即核外电子数相同
所以b+n=a-m,即b=a-m-n.
故答案为:a-m-n.
点评 本题考查原子和离子的相互转化、学生根据在化合物中正负化合价代数和为零计算指定元素化合价的解题能力,注意原子不显电性,原子的核内质子数和核外电子数相等;若质子数大于电子数,则微粒带正电;若质子数小于电子数,则微粒带负电,题目难度不大.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
9.在下列各组物质中,互为同分异构体的是( )
| A. | 甲烷与丙烷 | B. | 1H与2H | C. | O2与O3 | D. | 正丁烷与异丁烷 |
7.化学与生活、生产、社会关系密切.下列叙述正确的是( )
| A. | 铁制管道涂铝粉可防锈蚀 | |
| B. | 碳酸钡、碳酸氢钠、氢氧化镁等均可作为抗酸药物使用 | |
| C. | 焊锡中加铅的目的是提高熔点 | |
| D. | 用废旧皮革生产药用胶囊可以提高原料利用率 |
4.已知反应X+Y═M+N 为放热反应,对该反应的下列说法中正确的( )
| A. | X 的能量一定高于M | |
| B. | Y 的能量一定高于N | |
| C. | X 和Y 的总能量一定高于M 和N 的总能量 | |
| D. | 因该反应为放热反应,故不必加热就可发生 |
11.用NA表示阿伏德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,16g O2含有的原子数为1 NA | |
| C. | 通常状况下,1 NA 个SO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的K2CO3溶液中,含有CO32-个数为0.5 NA |
8.下列各组物质相互反应时,改变反应的条件、反应物的浓度或物质的量之比,生成的产物不变的是( )
| A. | 钠与空气 | B. | 铝盐与氢氧化钠溶液 | ||
| C. | CO2通入石灰水 | D. | 过氧化钠与水 |
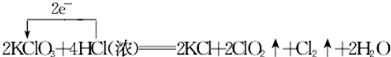 .
.