题目内容
9.KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯.其变化可表述为:2KClO3+4HCl(浓)═2KCl+2ClO2↑+Cl2↑+2H2O.(1)请分析该反应中电子转移的情况:(单线桥法表示)
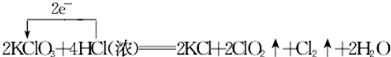 .
.(2)氧化剂与还原剂的物质的量之比是1:1.
(3)若产生标况下22.4L Cl2,则转移的电子的物质的量为2mol.
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19g•cm-3,为使用方便,请计算出该浓盐酸中HCl的物质的量浓度11.9 mol•L-1.
(5)ClO2对污水中Fe2+、Mn2+、S2-和CN-等有明显的去除效果.某工厂污水中含CN-a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为为2ClO2+2CN-=N2↑+2CO2↑+2Cl-,处理100m3这种污水,至少需要ClO2$\frac{50a}{13}$mol.
分析 (1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,据此分析;
(2)反应中KClO3为氧化剂,HCl为还原剂;
(3)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,据此计算转移电子物质的量;
(4)根据c=$\frac{1000ρw}{M}$来计算浓盐酸的物质的量浓度;
(5)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子;根据方程式计算需要ClO2的物质的量.
解答 解:(1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,化合价降低1价;HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高2价,则电子转移的方向和数目为: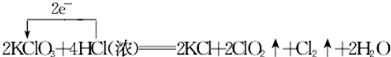
故答案为: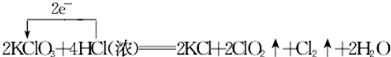 ;
;
(2)KClO3氯元素的化合价降低,是氧化剂,HCl中氯元素化合价由-1价升高为Cl2中0价,化合价升高,氯元素被氧化,则氧化剂与还原剂的物质的量之比为1:1,
故答案为:1:1;
(3)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生22.4L 即1molCl2,转移的电子的物质的量为1mol×2=2mol,
故答案为:2;
(4)由c=$\frac{1000ρw}{M}$可知,c=$\frac{1000×1.19×36.5%}{36.5}$=11.9 mol•L-1,
故答案为:11.9 mol•L-1.
(5)ClO2将CN-氧化,只生成两种气体,应生成氮气与二氧化碳,同时生成氯离子,反应离子方程式为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-,
100m3废水中CN-质量=100m3×ag/m3=100ag,CN-的物质的量为$\frac{100ag}{26g/mol}$=$\frac{50a}{13}$mol,由方程式可知,至少需要ClO2的物质的量=$\frac{50a}{13}$mol,
故答案为:2ClO2+2CN-=N2↑+2CO2↑+2Cl-;$\frac{50a}{13}$.
点评 本题考查了氯的化合物的性质、物质的量浓度的计算、氧化还原反应中转移的电子数的计算,明确化合价的变化是分析的关键,难点是消毒效率的计算,题目难度中等,侧重于考查学生阅读题目获取信息的能力、对浓度概念的理解、对氧化还原反应相关知识的运用以及在新情境下综合运用知识解决问题的能力.

| A. | ①③⑤ | B. | ②④⑦ | C. | ①②⑥ | D. | ②③⑥ |
| A. | 可以在空气中燃烧 | |
| B. | 与C12发生取代反应 | |
| C. | 可以与溴水中的溴反应而使溴水褪色 | |
| D. | 能使高锰酸钾溶液褪色 |
| A. | 1.8 g的NH4+离子中含有的电子数为0.1NA | |
| B. | 1mol Na2O2 固体中含离子总数为4NA | |
| C. | 标准状况下,2.24L CCl4所含的共价键数为O.4NA | |
| D. | 常温常压下,92g NO2和N2O4的混合气体含有的原子数为6NA |
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ | |
| B. | 用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ | |
| D. | 苯与氢气的反应: +3H2$→_{△}^{Ni}$ +3H2$→_{△}^{Ni}$ |
| A. | 365g 10%的盐酸 | B. | 22.4L 氯化氢 (已知密度为1.7g/L) | ||
| C. | 36.5g HCl气体. | D. | 0.5mol HCl气体 |
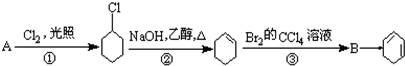
 ,B的名称是1,2-二溴环己烷.
,B的名称是1,2-二溴环己烷.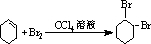 .
.