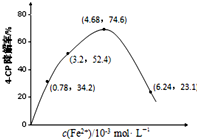
题目内容
10.依据氮元素及其化合物的转化关系,请回答下列问题.(1)实验室常用加热氯化铵和氢氧化钙的固体混合物制取氨气,该反应的化学方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)实验室检验氨气时,可选用的试剂是bc(填字母).
a.蓝色石蕊试纸b.红色石蕊试纸c.浓盐酸
(3)工业上用氨气制取NO的化学方程式是4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
分析 (1)氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气与水;
(2)氨气可以是湿润的红色石蕊试纸变蓝,与氯化氢反应生成氯化铵,冒白烟,据此检验氨气;
(3)工业上利用氨气与氧气发生催化氧化生成NO与水.
解答 解:(1)氯化铵与氢氧化钙在加热条件下反应生成氯化钙、氨气与水,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)氨气可以是湿润的红色石蕊试纸变蓝,与氯化氢反应生成氯化铵,冒白烟,据此检验氨气,
故答案为:bc;
(3)工业上利用氨气与氧气发生催化氧化制备NO,反应方程式为:4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2 $\frac{\underline{催化剂}}{△}$4NO+6H2O.
点评 本题考查氨气的制备与性质、氨气检验等知识点,掌握基础是解题关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.“泰诺林”是治疗感冒发烧的一种药物.其主要成份的结构简式如下: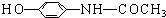 下列关于该物质的描述,不正确的是( )
下列关于该物质的描述,不正确的是( )
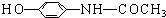 下列关于该物质的描述,不正确的是( )
下列关于该物质的描述,不正确的是( )| A. | 该化合物分子式为C8H9O2N | |
| B. | 能和银氨溶液发生银镜反应 | |
| C. | 能和氢氧化钠发生反应 | |
| D. | 其分子中的原子不可能都在同一平面上 |
15.下列物质中,属于芳香烃且属于苯的同系物的是( )
| A. |  | B. |  | C. |  | D. |  |
20.下列仪器:①锥形瓶,②蒸馏烧瓶,③漏斗,④燃烧匙,⑤天平,⑥分液漏斗,⑦胶头滴管.常用于物质分离的是( )
| A. | ①③⑤ | B. | ②④⑦ | C. | ①②⑥ | D. | ②③⑥ |
 如图所示的装置进行电解.通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.
如图所示的装置进行电解.通电一会儿,发现湿润的淀粉KI试纸的C端变为蓝色.
 .一定条件下,硫与地壳中含量最多的非金属元素X可组成两种常见的化合物,则X是O,两种化合物均含有的化学键为共价键
.一定条件下,硫与地壳中含量最多的非金属元素X可组成两种常见的化合物,则X是O,两种化合物均含有的化学键为共价键