题目内容
1.等质量的钠镁铝与足量的盐酸反应(1)相同物质的量的钠镁铝与足量盐酸反应放出氢气的体积比为1:2:3
(2)相同质量的钠镁铝与足量盐酸反应放出氢气的体积比为36:69:92
(3)若产生相同体积的(同温同压)氢气.所需钠镁铝物质的量之比6:3:2
(4)若产生相同体积的(同温同压)氢气.所需钠镁铝质量之比23:12:9.
分析 发生反应:2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,根据方程式计算解答.
解答 解:(1)分别取0.1mol钠、镁、铝与足量盐酸反应,则:
2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑,
0.1mol 0.05mol 0.1mol 0.1mol 0.1mol 0.15mol
故在相同条件下产生氢气的体积比=0.05mol:0.1mol:0.15mol=1:2:3,
故答案为:1:2:3;
(2)设wg钠、镁、铝与足量盐酸反应,则:
2Na+2HCl=2NaCl+H2↑、
46g 1mol
Wg x
$\frac{46g}{wg}$=$\frac{1mol}{x}$故x=$\frac{w}{46}$ mol
Mg+2HCl=MgCl2+H2↑
24g 1mol
Wg y
$\frac{24g}{wg}$=$\frac{1mol}{y}$故y=$\frac{w}{24}$mol
2Al+6HCl=AlCl3+3H2↑,
54g 3mol
Wg z
$\frac{54g}{w}$=$\frac{3mol}{z}$故Z=$\frac{w}{18}$mol
故wg钠、镁、铝与足量盐酸反应,相同条件下产生氢气的体积比=$\frac{w}{46}$:$\frac{w}{24}$:$\frac{w}{18}$=36:69:92;
故答案为:36:69:92;
(3)相同条件下生成氢气体积相同,则氢气物质的量相等,设氢气为3mol,则:
2Na+2HCl=2NaCl+H2↑、Mg+HCl=MgCl2+H2↑、2Al+6HCl=AlCl3+3H2↑
6mol 3mol 3mol 3mol 2mol 3mol
故所需钠、镁、铝的物质的量之比是6mol:3mol:2mol=6:3:2,
故答案为:6:3:2;
(4)由第(3)小题知需要钠、镁、铝的物质的量之比是6:3:2,
则质量比m(钠):m(镁):m(铝)=n(钠)×M(钠):n(镁)×M(镁):n(铝)×M(铝)
=23g/mol×6mol:24g/mol×3mol:27g/mol×2mol=23:12:9;
故答案为:23:12:9.
点评 本题考查根据方程式进行的计算,比较基础,掌握化学方程式计算方法是解题关键.

 阅读快车系列答案
阅读快车系列答案| A. | 标准状况下,22.4LH2O含有的分子数为1 NA | |
| B. | 常温常压下,16g O2含有的原子数为1 NA | |
| C. | 通常状况下,1 NA 个SO2分子占有的体积为22.4L | |
| D. | 物质的量浓度为0.5mol/L的K2CO3溶液中,含有CO32-个数为0.5 NA |
| A. | 蜂蜜中含有的葡萄糖 | B. | 石油中含有的C16H34 | ||
| C. | 芹菜中含有的纤维素 | D. | 植物油中含有的油脂 |
| A. | 标准状况下,22.4L乙醇中含有的氧原子数目为NA | |
| B. | 6.4g的S2和S8混合物中,含硫原子总数为0.2NA | |
| C. | 0.1 mol•L-1的NaHSO4溶液中含有阳离子的总数为0.2NA | |
| D. | 7.8 g Na2O2与水反应,转移的电子总数为0.2NA |
| A. | 原子半径X<Y | B. | 均有+3价 | ||
| C. | 最外层电子数均为5 | D. | 最外层均有2个电子 |
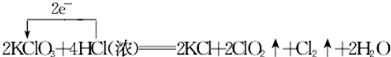 .
.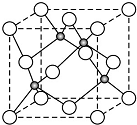 原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时成对电子数是其未成对电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题:
原子序数小于36的X、Y、Z、W四种元素,其中X是半径最小的元素,Y原子基态时成对电子数是其未成对电子总数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W原子4s原子轨道上有1个电子,M能层为全充满的饱和结构.回答下列问题: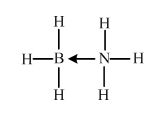 (必须标明配位键)
(必须标明配位键) ;
;