题目内容
8.如图所示是氨催化氧化制备硝酸的实验装量,下有关叙述正确的是( )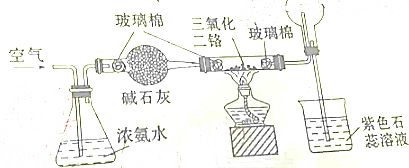
| A. | 烧杯中的紫色石蕊溶液不变色 | |
| B. | 圆底烧瓶中的气体一定为无色 | |
| C. | 加热后,通过三氯化二铬的气体由无色变为红棕色 | |
| D. | 三氯化二铬起氧化剂的作用 |
分析 由实验装置可知,氨气被碱石灰干燥后,在大试管中氨气与氧气反应生成NO,圆底烧瓶中NO被氧化生成红棕色NO2,NO2与水反应生成硝酸,以此来解答.
解答 解:由实验装置可知,氨气被碱石灰干燥后,在大试管中氨气与氧气反应生成NO,圆底烧瓶中NO被氧化生成红棕色NO2,NO2与水反应生成硝酸,
A.硝酸遇石蕊变红,则烧杯中的紫色石蕊溶液变红,故A错误;
B.圆底烧瓶中的气体可能为红棕色,故B错误;
C.加热后,通过三氯化二铬的催化作用生成无色NO,NO被氧化生成红棕色的气体NO2,故C正确;
D.氨气与氧气在三氯化二铬的催化作用反应生成NO和水,故D错误;
故选C.
点评 本题考查硝酸的制备实验评价,为高频考点,把握实验装置的作用、物质的性质及发生的反应为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
18.相同温度下,下列物质中导电性最强的是( )
| A. | 80ml 0.1 mol•L-1NaCl溶液 | B. | 50ml 0.1 mol•L-1MgSO4溶液 | ||
| C. | 100ml 0.1 mol•L-1氨水 | D. | 0.1 mol固体氯化钠 |
16.用我们日常生活中的食用白醋(醋酸浓度约为1mol•L-1)进行下列实验,能证明醋酸为弱电解质的是( )
| A. | 白醋中滴入石蕊试液呈红色 | |
| B. | 白醋加入豆浆中有沉淀产生 | |
| C. | 经检验白醋中c(H+)约为0.01 mol•L-1 | |
| D. | 蛋壳浸泡在白醋中有气体放出 |
3.下列物质在我们生活中常见,其中属于氧化物的是( )
| A. | 水 | B. | 食盐 | C. | 食醋 | D. | 酒 |
20.在溶液中能大量共存的离子组是( )
| A. | Na+、Cl-、NO3- | B. | Ca2+、Cl-、CO32- | C. | K+、H+、HCO3- | D. | Cu2+、H+、OH- |
18.将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一.已知:
TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140.5kJ?mol-1
C(s,石墨)+O2(g)═CO2(g)△H=-110.5kJ?mol-1
则反应TiO2(s)+2Cl2(g)+C(s,石墨)═TiCl4(l)+CO2(g)的△H是( )
TiO2(s)+2Cl2(g)═TiCl4(l)+O2(g)△H=+140.5kJ?mol-1
C(s,石墨)+O2(g)═CO2(g)△H=-110.5kJ?mol-1
则反应TiO2(s)+2Cl2(g)+C(s,石墨)═TiCl4(l)+CO2(g)的△H是( )
| A. | +30.0kJ?mol-1 | B. | -80.5kJ?mol-1 | C. | -30.0kJ?mol-1 | D. | +80.5kJ?mol-1 |