题目内容
5.现有失去标签的四瓶无色溶液分别为Na2CO3溶液、稀盐酸、Ba(OH)2溶液、NaHSO4溶液,为确定四瓶溶液分别是什么,将其随意标号为A、B、C、D,分别取少量溶液两两混合,产生的现象如下表所示.| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 生成白色沉淀 |
| ② | A+C | 放出无色气体 |
| ③ | A+D | 放出无色气体 |
| ④ | B+C | 无明显变化 |
| ⑤ | B+D | 生成白色沉淀 |
| ⑥ | C+D | 无明显变化 |
根据实验现象,回答下列问题:
(1)A为Na2CO3溶液,C为稀盐酸.
(2)写出下列反应的离子方程式
A+BCO32-+Ba2+=BaCO3↓,A+DCO32-+2H+=CO2↑+H2O,
(3)等物质的量浓度、等体积的B、D混合反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O,反应后得到的溶液中含有的阴离子有OH-.
(4)上述没有明显变化的实验④、⑥,其中④发生了离子反应,离子方程式为H++OH-=H2O.请设计实验证明其发生了反应取少量Ba(OH)2溶液滴入几滴酚酞试液,溶液显红色,向该红色溶液中加入稀盐酸至过量,溶液变为无色,说明酸碱发生反应.(试剂任选)
分析 根据反应现象和物质的性质进行推断,由表格中A能与C和D反应均有气体放出,可知A为碳酸钠溶液,C和D溶液均显酸性,则B为氢氧化钡溶液,B和C、D分别混合,B和D有沉淀,可知D为硫酸氢钠溶液,则C为稀盐酸,依此分析解答;
解答 解:根据反应现象和物质的性质进行推断,由表格中A能与C和D反应均有气体放出,可知A为碳酸钠溶液,C和D溶液均显酸性,则B为氢氧化钡溶液,B和C、D分别混合,B和D有沉淀,可知D为硫酸氢钠溶液,则C为稀盐酸,依此分析解答;
(1)可分析可知:A为碳酸钠溶液,C为稀盐酸,故答案为:Na2CO3溶液;稀盐酸;
(2)碳酸钠溶液和氢氧化钡溶液混合生成碳酸钡白色沉淀,发生反应的离子方程式为CO32-+Ba2+=BaCO3↓,碳酸钠溶液和硫酸氢钠溶液混合有二氧化碳气体放出,发生反应的离子方程式为CO32-+2H+=CO2↑+H2O,
故答案为:CO32-+Ba2+=BaCO3↓;CO32-+2H+=CO2↑+H2O;
(3)氢氧化钡溶液和硫酸氢钠溶液等体积等物质的量浓度反应生成水和硫酸钡沉淀,发生反应的离子方程式为Ba2++OH-+H++SO42-=BaSO4↓+H2O,从离子反应方程式可看出,等物质的量反应后溶液里剩余阴离子为OH-,故答案为:Ba2++OH-+H++SO42-=BaSO4↓+H2O;OH-;
(4)实验④中氢氧化钡溶液和盐酸混合没有明显现象,但发生了离子反应生成水,离子反应方程式为H++OH-=H2O
,可取少量Ba(OH)2溶液滴入几滴酚酞试液,溶液显红色,向该红色溶液中加入稀盐酸至过量,溶液变为无色,说明酸碱发生反应,
故答案为:④;H++OH-=H2O;取少量Ba(OH)2溶液滴入几滴酚酞试液,溶液显红色,向该红色溶液中加入稀盐酸至过量,溶液变为无色,说明酸碱发生反应.
点评 本题属于表格型推断题,考查溶液中物质之间的离子反应,把两两反应的现象归纳、列表,并和试题信息对照可得出结论,题目难度中等.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案| A. | 装有干海带的坩埚置于泥三角上加热灼烧 | |
| B. | 加入过量的氯水确保I-被完全氧化 | |
| C. | 用四氯化碳溶液萃取碘单质,上层为水层可以弃去 | |
| D. | 可利用碘单质易升华的特性来提纯碘单质 |
| A. | 白醋中滴入石蕊试液呈红色 | |
| B. | 白醋加入豆浆中有沉淀产生 | |
| C. | 经检验白醋中c(H+)约为0.01 mol•L-1 | |
| D. | 蛋壳浸泡在白醋中有气体放出 |
| A. | Na+、Cl-、NO3- | B. | Ca2+、Cl-、CO32- | C. | K+、H+、HCO3- | D. | Cu2+、H+、OH- |
| A. | 水电离出的c(OH):③>①>② | |
| B. | 溶液的pH:②>③>① | |
| C. | ①和②等体积混合后的溶液:c(Na+)═c(H2C03)+c(HC03)+c(C032-) | |
| D. | ①和③等体积混合后的溶液:c(Na+)>c(HC03-)>c(C032-)>c(OH-)>c(H+) |
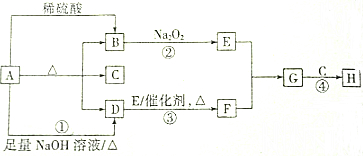

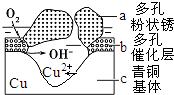 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义.
我国古代青铜器工艺精湛,有很高的艺术价值和历史价值.但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义.