题目内容
17.常温下,0.1mol•L-1的HA溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8,下列叙述中正确的是( )| A. | 0.01 mol•L-1HA的溶液中c(H+)=1×10-4mol•L-1 | |
| B. | pH=3的HA溶液与pH=11的NaOH溶液等体积混合后所得溶液中c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol•L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则 c(OH-)-c(H+)<c(HA)-c(A-) | |
| D. | pH=3的HA溶液与pH=11的NaOH溶液按体积比1:10混合后所得溶液中 c(OH-)+c(A-)═c(H+)+c(Na+) |
分析 根据溶液中c(OH-)与c(H+)的比值结合溶液的离子积常数Kw计算出溶液的c(H+),判断出酸的强弱性质,再根据与碱反应的性质判断反应后溶液的pH,进而判断反应后溶液中离子浓度的大小比较.
A、依据$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8和水的离子积Kw=1×10-14,计算得到酸溶液中的氢离子浓度为c(H+)=0.001mol/L;
B、HA为弱酸,NaOH为强碱,氢离子浓度与氢氧根离子浓度相同时,HA的浓度比NaOH大;
C、浓度均为0.1 mol•L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,说明HA的电离程度大于酸根离子水解程度;
D、任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:A、溶液中$\frac{c(O{H}^{-})}{c({H}^{+})}$=1×10-8,Kw=c(H+)•c(OH-)=1×10-14,两式中的氢离子浓度是溶液中酸电离出的,氢氧根离子浓度是水电离出的,联立解得c(H+)=0.001mol/L,故A错误;
B、相同体积的PH=3的HA溶液与PH=11的NaOH溶液中HA的物质的量比NaOH多,混合后溶液显酸性,离子浓度大小顺序应为c(A-)>c(Na+)>c(H+)>c(OH-),故B错误;
C、浓度均为0.1 mol•L-1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,说明HA的电离程度大于酸根离子水解程度,溶液中存在电荷守恒c(OH-)+c(A-)=c(H+)+c(Na+),存在物料守恒2c(Na+)=c(HA)+c(A-),c(OH-)-c(H+)=c(Na+)-c(A-)=$\frac{c({A}^{-})+c(HA)}{2}$-c(A-)=$\frac{c(HA)-c({A}^{-})}{2}$>c(HA)-c(A-),
c(HA)-c(A-)为负值,故C错误;
D、任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(OH-)+c(A-)=c(H+)+c(Na+),故D正确;
故选D.
点评 本题考查了弱电解质的电离,根据氢离子浓度和氢氧根离子浓度的关系确定酸的强弱,再根据溶液中的溶质及其性质确定溶液酸碱性、离子浓度大小,注意守恒思想的灵活运用,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 缺少限制条件,无法测定 | B. | H+离子浓度相同 | ||
| C. | 温度低时,H+离子浓度大 | D. | 温度高时,H+离子浓度大 |
(1)准确称量8.6g含有少量中性易溶杂质的样品,配成500mL待测溶液.称量时,样品可放在C(填编号字母)称量.
A.托盘上 B.洁净纸片上 C.小烧杯中
(2)滴定时,用0.2000mol•L-1的盐酸来滴定待测溶液,不可选用A (填编号字母)作指示剂.
A.石蕊 B.甲基橙 C.酚酞
(3)滴定过程中,眼睛应注视锥形瓶内溶液颜色的变化;在铁架台上垫一张白纸,其目的是便于观察锥形瓶内液体颜色的变化,减小滴定误差.
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是0.4000mol•L-1,烧碱样品的纯度是93.02%.
| 滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10 | 0.5 | 20.6 |
| 第二次 | 10 | 4.2 | 24.1 |
①滴定前酸式滴定管尖嘴处有气泡,滴定后充满溶液偏高;
②读取标准溶液体积时,滴定前仰视,滴定终点时平视偏低.
 某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:
某学生用NaOH标准溶液滴定未知浓度的盐酸,进项了如下实验:Ⅰ.实验步骤:(请填空)
(1)滴定管在使用前应先检验是否漏液,然后用蒸馏水洗涤,最后用待装液润洗.
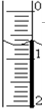
(2)将氢氧化钠溶液装入滴定管排除气泡并调节液面.如果页面初始位置如图所示,则此时的读数为0.70mL.
(3)取15.00mL待测盐酸装入锥形瓶中,滴加2滴酚酞作指示剂,滴定是边滴边摇动锥形瓶,眼睛应观察b(选填编号).
a.滴定管内液面的变化 b.锥形瓶内溶液颜色的变化
Ⅱ.实验记录:
| 实验次数 | 待测盐酸体积(mL) | 标准氢氧化钠溶液体积(mL) | ||
| 初读数 | 末读数 | 消耗体积 | ||
| 1 | 15.00 | 0.50 | 17.75 | 17.25 |
| 2 | 15.00 | 0.05 | 16.10 | 16.05 |
| 3 | 15.00 | 0.00 | 15.95 | 15.95 |
Ⅲ.数据处理与讨论:
(5)处理数据时应舍去误差明显过大的异常数据,余下的数据中NaOH溶液的平均消耗值是16.00mL.若
NaOH标准溶液的浓度为0.1020mol/L,该盐酸的浓度为0.1088mol/L.
(6)在本实验过程中,下列操作不会造成实验误差的是a(选填编号).
a.锥形瓶中加入待测溶液后,再加少量蒸馏水
b.锥形瓶在滴定时剧烈摇动,有少量液体溅出
c.见到指示剂的颜色有变化即停止滴定.
| A. | HBr、CO2、H2O、CS2 | B. | Cl2、Na2S、HCl、SO2 | ||
| C. | NaCl、HCl、H2O、NaOH | D. | Na2O2、H2O2、H2O、O3 |
