题目内容
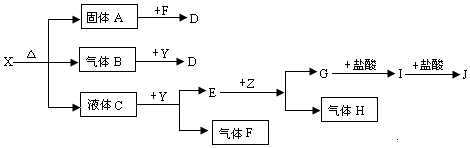
9.A、B、C、D是四种元素的原子,质子数都小于20.A原子与B原子的最外层电子数相同,B原子与C原子的核外电子层数相同,0.2mol C单质与足量稀硫酸反应时放出 H2 6.72L(标准状况),A原子最外层上的电子数比次外层上的电子数多5个,C原子与D原子的质子数之和为32.(1)A、B、C、D的元素符号分别为F、Cl、Al、K.
(2)A的离子结构示意图为
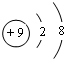 ,C的原子结构示意图为
,C的原子结构示意图为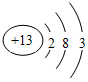 .
.(3)C的硫酸盐的化学式为Al2(SO4)3,C单质与稀硫酸反应的化学方程式为2Al+3H2SO4═Al2(SO4)3+3H2↑.
分析 A、B、C、D是四种元素的原子,质子数都小于20,A原子最外层上的电子数比次外层上的电子数多5个,则A含有2个电子层,最外层含有7个电子,为F元素;A原子与B原子的最外层电子数相同,A、B位于同一主族,则B为Cl元素;B原子与C原子的核外电子层数相同,则B、C位于第三周期;0.2mol C单质与足量稀硫酸反应时放出 H2 6.72L(标准状况),氢气的物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol,根据电子守恒可知1molC失去电子的物质的量为:$\frac{0.3mol×2}{0.2mol}$=3,则C为Al元素;C原子与D原子的质子数之和为32,则D的质子数=32-13=19,则D为K元素,据此结合元素周期律知识解答.
解答 解:A、B、C、D是四种元素的原子,质子数都小于20,A原子最外层上的电子数比次外层上的电子数多5个,则A含有2个电子层,最外层含有7个电子,为F元素;A原子与B原子的最外层电子数相同,A、B位于同一主族,则B为Cl元素;B原子与C原子的核外电子层数相同,则B、C位于第三周期;0.2mol C单质与足量稀硫酸反应时放出 H2 6.72L(标准状况),氢气的物质的量为:$\frac{6.72L}{22.4L/mol}$=0.3mol,根据电子守恒可知1molC失去电子的物质的量为:$\frac{0.3mol×2}{0.2mol}$=3,则C为Al元素;C原子与D原子的质子数之和为32,则D的质子数=32-13=19,则D为K元素,
(1)根据分析可知,A、B、C、D分别为F、Cl、Al、K,
故答案为:F;Cl;Al;K;
(2)氟离子的核电荷数为9,核外电子总数为10,其离子结构示意图为: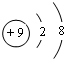 ;
;
铝原子的核电荷数=核外电子总数=13,其原子结构示意图为: ,
,
故答案为: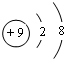 ;
; ;
;
(3)C的硫酸盐为硫酸铝,其化学式为:Al2(SO4)3;
C的单质为Al,铝与稀硫酸反应的离子方程式为:2Al+3H2SO4═Al2(SO4)3+3H2↑,
故答案为:Al2(SO4)3;2Al+3H2SO4═Al2(SO4)3+3H2↑.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,推断元素为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及逻辑推理能力.

 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案| A. | 由电子定向移动而导电的物质不一定是金属 | |
| B. | 熔融态的NaHSO4能导电,则中只含有离子键 | |
| C. | HF的沸点高于HCl是因为F的非金属性比Cl强 | |
| D. | 足球烯(C60)和金刚石均为原子晶体,熔化时破坏共价键 |
| A. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA | |
| B. | 标准状况下,22.4LH2O含有的分子数为 NA | |
| C. | 通常状况下,NA 个CO2分子占有的体积为22.4L | |
| D. | 物质的量为0.5 mol的MgCl2中,含有Mg2+个数为 NA |
| A. | 密度比4:11 | B. | 分子数之比为4:11 | ||
| C. | 体积比4:11 | D. | 物质的量之比为4:11 |
| A. | 在紫外线、饱和(NH4)2SO4溶液、CuSO4溶液、福尔马林等作用下,蛋白质均会发生变性 | |
| B. | 用新制Cu(OH)2悬浊液可鉴别麦芽糖和蔗糖 | |
| C. | 为检验皂化反应进行程度,取几滴反应液,滴入装有热水的试管中,震荡,若有油滴浮在液面上,说明油脂已完全反应 | |
| D. | CH3CH2Br中滴加AgNO3溶液观察是否有浅黄色沉淀,判断卤代烃的类型 |
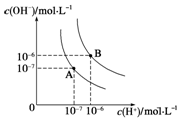 水的电离平衡曲线如图所示,若A点、B点分别表示25℃和100℃时水的电离达平衡时的离子浓度.则表示25℃的是A (填“A”或“B”).100℃时,在1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1.100℃时,5×10-5 mol•L-1的H2SO4溶液与pH=9的Ba(OH)2溶液混合后pH=7,则混合前H2SO4溶液与Ba(OH)2溶液的体积比为9:1.
水的电离平衡曲线如图所示,若A点、B点分别表示25℃和100℃时水的电离达平衡时的离子浓度.则表示25℃的是A (填“A”或“B”).100℃时,在1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1.100℃时,5×10-5 mol•L-1的H2SO4溶液与pH=9的Ba(OH)2溶液混合后pH=7,则混合前H2SO4溶液与Ba(OH)2溶液的体积比为9:1.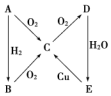 根据如图所示转化关系,判断A、B、C、D各是什么物质,写出有关的化学方程式:
根据如图所示转化关系,判断A、B、C、D各是什么物质,写出有关的化学方程式: