题目内容
11.下列说法正确的是( )| A. | 由电子定向移动而导电的物质不一定是金属 | |
| B. | 熔融态的NaHSO4能导电,则中只含有离子键 | |
| C. | HF的沸点高于HCl是因为F的非金属性比Cl强 | |
| D. | 足球烯(C60)和金刚石均为原子晶体,熔化时破坏共价键 |
分析 A.碳导电也是由于电子定向移动;
B.熔融状态下能导电的化合物一定含有离子键,可能含有共价键;
C.元素的非金属性强弱与其氢化物的熔沸点高低无关;
D.足球烯(C60)属于分子晶体.
解答 解:A.碳导电也是由于电子定向移动,所以由电子定向移动而导电的物质不一定是金属,故A正确;
B.熔融态的NaHSO4能导电,则一定含有离子键,但HSO4-内部还含有共价键,故B错误;
C.氢化物的熔沸点与相对分子质量、氢键有关,与非金属性强弱无关,故C错误;
D.足球烯(C60)属于分子晶体,故D错误;
故选A.
点评 本题考查导电性的判断、非金属性强弱判断以及晶体类型,为高频考点,注意氢化物的熔沸点与相对分子质量与氢键有关,与非金属性强弱无关.

练习册系列答案
相关题目
1.下列叙述正确的是( )
| A. | 每摩尔物质约含有6.02×1023个粒子 | |
| B. | 摩尔是七个基本物理量之一 | |
| C. | 摩尔是物质的质量单位 | |
| D. | 摩尔是物质的数量单位 |
19.电池是化学能转化为电能的装置,下列电池的能量转化率最高的是( )
| A. | 铅蓄电池 | B. | 碱性锌锰干电池 | C. | 锂离子可充电池 | D. | 甲醇燃料电池 |
6.下列指定反应的离子方程式正确的是( )
| A. | FeO溶于稀硝酸:FeO+2H+═Fe2++H2O | |
| B. | Al2(SO4)3溶液中加入过量Ba(OH)2溶液:Al3++4OH-═AlO2-+2H2O | |
| C. | 漂白粉溶液中通入少量CO2:2ClO-+H2O+CO2═2HClO+CO32- | |
| D. | 等物质的量的NO和NO2同时被NaOH溶液吸收:NO+NO2+2OH-═2NO2-+H2O |
4.设标准状况下,1体积水溶解700体积氨气,所得溶液的密度为0.901g•cm-3,则氨水中溶质的物质的量浓度是( )
| A. | 18.4 mol•L-1 | B. | 34.7% | C. | 20.4 mol•L-1 | D. | 31.2% |
11.下列说法不正确的是( )
| A. | 13C表示核内有6个质子,核外有7个电子的一种核素 | |
| B. | 氧气O2和臭氧O3互为同素异形体 | |
| C. | CH3OCH3和CH3CH2OH是互为同分异构体 | |
| D. | 磁性纳米材料是直径为1~100nm(1nm=10-9m)的磁性粒子分散在基础物质中所形成的具有胶体性质的一种材料 |
8.下列状态时,能够导电的电解质是( )
| A. | 液态氯化氢 | B. | 熔融烧碱 | C. | 氯化钠晶体 | D. | 氯气 |




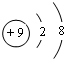 ,C的原子结构示意图为
,C的原子结构示意图为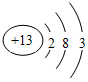 .
.