题目内容
14.如图中所有物质均为中学化学常见物质,F、H是气体单质,Z是固体金属单质,Y中阳离子与阴离子个数比为2:1,化合物X、Y、A、D、E、G的焰色反应为黄色,I是白色沉淀.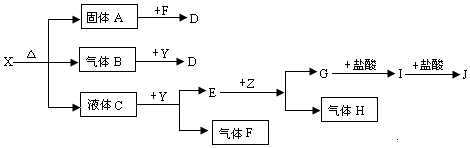
(1)写出X、E、I的化学式:XNaHSO3、ENaOH、IAl(OH)3;
(2)关于Y的说法正确的是ABC;
A.Y是氧化物 B.Y是过氧化物C.Y是强电解质 D.Y是碱性氧化物
(3)写出E+Z的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)写出B和Y反应的化学方程式:Na2O2+SO2=Na2SO4;
(5)已知X和G的溶液反应能生成白色沉淀,试写出该反应的离子反应方程式HSO3-+AlO2-+H2O=SO32-+Al(OH)3↓.
分析 化合物X、Y、A、D、E、G的焰色反应为黄色,均含有Na元素,Y中阳离子与阴离子个数比为2:1,与液体C反应生成气体单质F,应是过氧化钠与水的反应,可推知Y为Na2O2、C为H2O,则E为NaOH、F为O2,Z是固体金属单质,与氢氧化钠反应生成气体单质H,故Z为Al、H为H2、G为NaAlO2,I是白色沉淀,则I为Al(OH)3,J为AlCl3.固体A与氧气反应生成D,气体B与过氧化钠反应生成D,固体A与气体B具有还原性,则A为Na2SO3,B为SO2,D为Na2SO4,可推知X为NaHSO3,据此解答.
解答 解:化合物X、Y、A、D、E、G的焰色反应为黄色,均含有Na元素,Y中阳离子与阴离子个数比为2:1,与液体C反应生成气体单质F,应是过氧化钠与水的反应,可推知Y为Na2O2、C为H2O,则E为NaOH、F为O2,Z是固体金属单质,与氢氧化钠反应生成气体单质H,故Z为Al、H为H2、G为NaAlO2,I是白色沉淀,则I为Al(OH)3,J为AlCl3.固体A与氧气反应生成D,气体B与过氧化钠反应生成D,固体A与气体B具有还原性,则A为Na2SO3,B为SO2,D为Na2SO4,可推知X为NaHSO3,
(1)由上述分析可知,X为NaHSO3,E为NaOH,I为Al(OH)3,
故答案为:NaHSO3;NaOH;Al(OH)3;
(2)Y为Na2O2,属于过氧化物,也属于氧化物,含有活泼金属元素和活泼非金属元素,是离子化合物,属于强电解质,故ABC正确,
故答案为:ABC;
(3)铝与NaOH反应的离子方程式2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(4)B和Y反应是二氧化硫与过氧化钠反应生成硫酸钠,化学方程式为:Na2O2+SO2=Na2SO4,
故答案为:Na2O2+SO2=Na2SO4;
(5)亚硫酸氢钠和偏铝酸钠反应生成氢氧化铝沉淀与亚硫酸钠,反应离子方程式为:HSO3-+AlO2-+H2O=SO32-+Al(OH)3↓,
故答案为:HSO3-+AlO2-+H2O=SO32-+Al(OH)3↓.
点评 本题考查无机物推断,涉及Na、S、Al元素化合物性质与转化,焰色反应及Y与C的反应为推断突破口,X与B的推断为易错点、难点,中学基本不涉及,注意根据氧化还原反应进行推断,需要学生熟练掌握元素化合物性质,题目难点中等.

| A. | 18.4 mol•L-1 | B. | 34.7% | C. | 20.4 mol•L-1 | D. | 31.2% |
| A. | Cl2的摩尔质量是71g | |
| B. | 1molCl2中所含分子数约为6.02×1023 | |
| C. | 1molCl2的质量是71g•mol-1 | |
| D. | 常温常压下,1molCl2的体积为22.4L |
| A. | pH=1的溶液:NH4+、Fe3+、CO32-、SO42- | |
| B. | 含有大量AlO2-的溶液中:Fe2+、Cu2+、Cl-、Na+ | |
| C. | 中性溶液中:Fe3+、Al3+、Na+、K+、NO3- | |
| D. | Na2S溶液中:K+、NH4+、Cl-、SO42- |
| A. | 某溶液中存在的离子只有Cl-、OH-、NH4+、H+,该溶液中离子浓度大小关系可能为c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1 HA(一元酸)溶液与0.1 mol•L-1的NaOH溶液等体积混合:c(H+)+c(Na+)=c(OH-)+c(A-) | |
| C. | 常温下0.1 mol/L的下列溶液:①NH4Al(SO4)2、②NH4Cl、③NH3•H2O、④CH3COONH4中,c(NH4+)由大到小的顺序是②>①>④>③ | |
| D. | 常温下0.4 mol/L HA溶液和0.2 mol/L NaOH溶液等体积混合后溶液的pH=3,假设溶液体积可以相加,则混合溶液中离子浓度的大小顺序为c(A-)>c(H+)>c(Na+)>c(OH-) |
| A. | 铜的金属活动性比铁弱,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| B. | 铝热剂、福尔马林、水玻璃、漂白粉均为混合物 | |
| C. | 一定条件下,1mol苯甲醛最多能与3molH2反应 | |
| D. | 乙醇、乙酸均能与NaOH稀溶液反应,因为分子中均含有官能团“-OH” |
| A. | 在容量瓶中先加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸 | |
| B. | 用浓盐酸配制1:1(体积比)的稀盐酸(约6 mol•L-1)通常需要用容量瓶等仪器 | |
| C. | 配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4以防水解 | |
| D. | 用pH=1的盐酸配制100 mL pH=2的盐酸所需全部玻璃仪器有100 mL容量瓶、烧杯、玻璃棒、胶头滴管 |
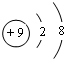 ,C的原子结构示意图为
,C的原子结构示意图为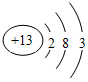 .
.