题目内容
1.在标准状况下,等质量的CH4和CO2比较,下列说法中正确的是( )| A. | 密度比4:11 | B. | 分子数之比为4:11 | ||
| C. | 体积比4:11 | D. | 物质的量之比为4:11 |
分析 A、相同状态下,气体的密度之比等于相对分子质量之比;
B、等质量时,物质的量和摩尔质量成反比,而分子个数和物质的量成正比;
C、体积之比等于物质的量之比;
D、等质量时,物质的量和摩尔质量成反比.
解答 解:A、相同状态下,气体的密度之比等于相对分子质量之比,故甲烷和二氧化碳的密度之比等于16:44=4:11,故A正确;
B、等质量时,物质的量和摩尔质量成反比,而分子个数和物质的量成正比,即$\frac{{N}_{1}}{{N}_{2}}=\frac{{n}_{1}}{{n}_{2}}=\frac{{M}_{2}}{{M}_{1}}$,由于甲烷和二氧化碳的摩尔质量之比为4:11,故两者的分子个数之比为11:4,故B错误;
C、体积之比等于物质的量之比,而当质量相同时,物质的量之比和摩尔质量成反比,故有:$\frac{{V}_{1}}{{V}_{2}}=\frac{{n}_{1}}{{n}_{2}}=\frac{{M}_{2}}{{M}_{1}}$,故甲烷和二氧化碳的体积之比为11:4,故C错误;
D、等质量时,物质的量和摩尔质量成反比,故甲烷和二氧化碳的物质的量之比为11:4,故D错误.
故选A.
点评 本题考查了阿伏伽德罗定律的有关应用,综合性较强,考查了学生的基础知识和逻辑思维的解题能力.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案
相关题目
11.下列说法不正确的是( )
| A. | 13C表示核内有6个质子,核外有7个电子的一种核素 | |
| B. | 氧气O2和臭氧O3互为同素异形体 | |
| C. | CH3OCH3和CH3CH2OH是互为同分异构体 | |
| D. | 磁性纳米材料是直径为1~100nm(1nm=10-9m)的磁性粒子分散在基础物质中所形成的具有胶体性质的一种材料 |
12.下列实验方法能达到实验目的是( )
| A. | 用分液漏斗从食醋中分离出乙酸 | |
| B. | 用焰色反应鉴别Na2SO4和Na2CO3 | |
| C. | 用NaOH溶液除去Cl2中含有的少量HCl | |
| D. | 用KSCN溶液检验FeCl3溶液 中是否含有Fe3+ |
16.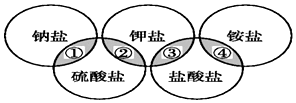 下列各项中的物质,能满足如图中阴影部分关系的是( )
下列各项中的物质,能满足如图中阴影部分关系的是( )
 下列各项中的物质,能满足如图中阴影部分关系的是( )
下列各项中的物质,能满足如图中阴影部分关系的是( )| ① | ② | ③ | ④ | |
| A | NaCl | K2SO4 | KCl | (NH4)2SO4 |
| B | NaCl | K2SO4 | KCl | NH4Cl |
| C | Na2SO4 | K2SO4 | KCl | NH4Cl |
| D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
| A. | A | B. | B | C. | C | D. | D |
13.某溶液中含有Na+、Fe2+、Cu2+、SO42-、I-几种离子,向其中通入足量Cl2后,溶液中离子浓度明显减少的是( )
| A. | I- | B. | Fe2+ | C. | Cu2+ | D. | SO42- |
10.下列有关溶液组成的描述合理的是( )
| A. | 无色溶液中可能大量存在Al3+、NH4+、Cl?、S2? | |
| B. | 酸性溶液中可能大量存在Na+、ClO?、SO42?、I? | |
| C. | 强碱性溶液中可能大量存在Na+、K+、Cl?、CO32? | |
| D. | 中性溶液中可能大量存在Fe3+、K+、Cl?、SO42? |
19.短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Y原子P能级上有2个未成对电子,Z原子比X原子的核外电子数多4.下列说法正确的是( )
| A. | X、Y、Z的电负性大小顺序是Z<Y<X | |
| B. | WY2分子中σ键与π键的数目之比是2:1 | |
| C. | W、X、Y、Z的原子半径大小顺序是X>Y>Z>W | |
| D. | W、Z形成的分子的空间构型是三角锥形 |
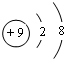 ,C的原子结构示意图为
,C的原子结构示意图为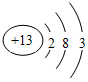 .
.