题目内容
16.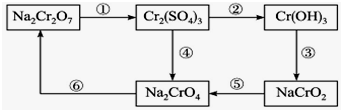 铬是水体的主要的污染物之一,可以导致水生生物死亡.化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质.例如处理铬的实验循环示意图如图:
铬是水体的主要的污染物之一,可以导致水生生物死亡.化学实验中,如使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境排放该有害物质.例如处理铬的实验循环示意图如图:(1)在如图所示的编号步骤中,其中反应①所用的试剂是硫酸酸化的H2O2,请写出该反应的离子方程式Cr2O72-+8H++3H2O2═2Cr3++3O2↑+7H2O.
(2)现有含Cr3+和Fe3+的溶液,使用NaOH溶液和盐酸,可将这两种离子相互分离,根据如图信息分析,在涉及的过滤操作中,上述两种离子的存在形态分别是CrO2-(或NaCrO2)、Fe(OH)3. (写化学式)
(3)铬的化合价除了示意图中涉及的+3和+6外,还有0、+2、+4和+5等.
现有24mL浓度为0.05mol•L-1的Na2SO3溶液恰好与20mL浓度为0.02mol•L-1的Na2Cr2O7溶液完全反应.已知Na2SO4被Na2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为+3.
(4)步骤⑤应该加入氧化剂(填“还原”或“氧化”).
分析 (1)H2O2既具有氧化性,又具有还原性;Cr2O72-具有强氧化性,能将H2O2氧化为O2,反应中+6价Cr元素被还原为+3价;
(2)从反应③可以看出,Cr(OH)3可以与NaOH溶液反应生成NaCrO2,所以除去Fe3+中的Cr3+时,可以加入过量的NaOH溶液,使Cr3+转化为CrO,Fe3+转化为Fe(OH)3沉淀,在过滤得到的Fe(OH)3中加入盐酸即得到FeCl3溶液;
(3)Na2SO3被氧化为Na2SO4,S元素化合价由+4价升高为+6价;Na2Cr2O7中Cr元素发生还原反应,令Cr元素在产物中的化合价为a价,根据电子转移守恒计算a的值;
(4)Cr元素的化合价从+3升高到了+6价,Cr元素被氧化.
解答 解:(1)H2O2既具有氧化性,又具有还原性;Cr2O72-具有强氧化性,能将H2O2氧化为O2,反应中+6价Cr元素被还原为+3价,离子反应为Cr2O72-+8H++3H2O2═2Cr3++3O2↑+7H2O,
故答案为:Cr2O72-+8H++3H2O2═2Cr3++3O2↑+7H2O;
(2)从反应③可以看出,氢氧化铬可以和氢氧化钠反应生成NaCrO2,所以除去铁离子中的铬离子时可以加入过量的氢氧化钠,是铬离子转化为CrO2-(或NaCrO2),铁离子变成Fe(OH)3沉淀,在过滤得到氢氧化铁沉淀中加入盐酸即得到氯化铁溶液,
故答案为:CrO2-(或NaCrO2);Fe(OH)3;
(3)令Cr元素在产物中的化合价为a价,根据电子转移守恒,则:24×10-3L×0.05mol/L×(6-4)=20×10-3L×0.02mol/L×2×(6-a),解得a=+3,
故答案为:+3;
(4)步骤⑤中,Cr元素的化合价从+3升高到了+6价,所以需要加入氧化剂,
故答案为:氧化.
点评 本题考查氧化还原反应及计算,为高频考点,把握发反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,注意(3)中电子守恒应用,题目难度不大.

 计算高手系列答案
计算高手系列答案| A. | 44 g CO2 | B. | 1.5 mol H2 | ||
| C. | 标况下22.4L SO2 | D. | 3.01×1023个硫酸分子 |
| A. | 海水中最丰富的资源是食盐 | |
| B. | 现代社会绝大部分食盐用于食用 | |
| C. | 古代我国就在海滩晒盐,这称为盐田法 | |
| D. | 目前我国海盐年产量名列世界第一 |
| A. | 普通盐酸的酸性太强 | |
| B. | 普通盐酸具有挥发性 | |
| C. | 普通盐酸和月球岩石中的碳化物无法反应 | |
| D. | 无法区别岩石中原来含有的是碳化物,还是碳氢化合物 |
| A. | 将容器体积变为20 L,Z的平衡浓度变为原来的1/2 | |
| B. | 以X的反应速率为0.001 mol•L-1•s-1 | |
| C. | 若增大压强,则物质Y的转化率减小 | |
| D. | 若升高温度,X的体积分数增大,则该反应的△H>0 |
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
(2)①③⑤三种元素的最高价氧化物对应水化物中,碱性最强的化合物的化学式是NaOH
(3)①②③三种元素的原子半径由大到小的顺序是K>Na>Mg.
(4)⑧⑨两种元素氢化物稳定性强弱的顺序是HCl>HBr,它们都是分子晶体.
(5)①⑧两种元素形成的化合物属于离子化合物(填“共价”或“离子”,下同),⑥⑧两种元素形成的化合物属于共价化合物.