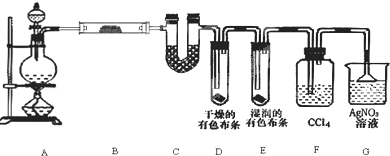
题目内容
13. 瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:(1)B中发生反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)漂白粉将在U形管中产生,其化学方程式是2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.
(3)此实验结果所得Ca(ClO)2产率太低,经分析并查阅资料发现,主要原因是在U形管中存在两个副反应:
①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,可采取的措施是将U形管置于冷水浴中.
②试判断另一个副反应(写出此反应方程式):Ca(OH)2+2HCl═CaCl2+2H2O.为避免此副反应发生,应采取的措施是在B、C之间增加一个饱和食盐水洗气装置.
分析 (1)B中二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水;
(2)氯气通入石灰乳反应生成氯化钙、次氯酸钙和水;
(3)①因为温度高时易生成Ca(ClO3)2,所以避免此反应发生可以采取降温措施;
②浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢能够与氢氧化钙反应生成氯化钙和水,为避免此副反应发生,应除去氯气中的氯化氢.
解答 解:(1)二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气和水,化学方程式:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
故答案为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O;
(2)氯气通入石灰乳反应生成氯化钙、次氯酸钙和水,化学方程式:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)①温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,用冰水或冷水冷却,故答案为:将U型管置于冷水浴中.
②浓盐酸易挥发,制备的氯气中含有氯化氢,氯化氢能够与氢氧化钙反应生成氯化钙和水,化学方程式为Ca(OH)2+2HCl═CaCl2+2H2O;
为避免此副反应发生,应除去氯气中的氯化氢,氯化氢易溶于饱和食盐水,氯气在饱和食盐水中溶解度不大,所以可以在B、C之间增加一个饱和食盐水洗气装置;
故答案为:Ca(OH)2+2HCl═CaCl2+2H2O;在B、C之间增加一个饱和食盐水洗气装置.
点评 本题考查了实验室制漂白粉的装置分析和制备条件判断,明确制备原理是解题关键,注意题干信息及对反应条件的控制,题目难度不大.

 阅读快车系列答案
阅读快车系列答案
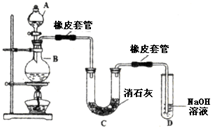
| A. | A 中可用分液漏斗代替长颈漏斗 | |
| B. | A 中缺少加热装置 | |
| C. | B 中盛放的NaOH 溶液可以净化Cl2 | |
| D. | D 中盛放的NaOH 溶液可以吸收尾气 |
 (1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
(1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
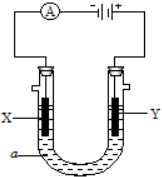 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: