题目内容
3. (1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.
(1)某可逆反应在不同条件下的反应历程分别为A、B,如图所示.①据图判断该反应是吸(填“吸”或“放”)热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率增大(填“增大”、“减小”或“不变”);
②其中B历程表明此反应采用的条件为D(选填序号).
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
(2)1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g)该反应的平衡常数表达式为$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$.
已知K1000℃<K1200℃,若降低体系温度,混合气体的平均相对分子质量将减小(填“增大”、“减小”或“不变”)
(3)生铁在潮湿空气中会发生吸氧腐蚀.
①电解质溶液可选用(填序号)AC.
A.NaOH溶液 B.C2H5OH C.NaCl溶液 D.稀硫酸
②写出生铁在潮湿空气中吸氧腐蚀正极的电极反应式2H2O+O2+4e-=4OH-.
分析 (1)①由图可知,反应物的总能量低于生成物的总能量,该反应为吸热反应;升高温度平衡向逆反应方向移动,据此解答;
②由图可知,反应历程B与A相比,改变反应历程,应是使用催化剂;
(2)化学平衡常数,是指在一定温度下,可逆反应达到平衡时各生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,据此书写,注意当反应中有固体物质参加时,固体的“浓度”作为常数,在平衡常数表达式中,就不写固体的浓度,稀溶液中的水分子浓度可不写,对于非水溶液中的反应,溶剂的浓度同样是常数;K1000℃<K1200℃,则正反应为吸热反应,降低体系温度,平衡向逆反应方向移动,混合气体总质量减小,总的物质的量不变,据此判断;
(3)①发生吸氧腐蚀应在碱性或中性溶液中进行;
②铁在潮湿的空气中发生吸氧腐蚀时,正极上是氧气得电子的过程,铁的锈蚀实际是铁与空气中的水和氧气共同作用的结果.
解答 解:(1)①由图可知,反应物的总能量低于生成物的总能量,该反应为吸热反应;升高温度平衡向正反应方向移动,反应物的转化率增大;
故答案为:吸;增大;
②由图可知,反应历程B与A相比,改变反应历程,最后达到相同的平衡状态,改变的条件应是使用催化剂,降低反应的活化能,加快反应速率;
故答案为:D;
(2)Na2SO4(S)+4H2(g)═Na2S(s)+4H2O(g)的平衡常数表达式k=$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$;
K1000℃<K1200℃,则正反应为吸热反应,降低体系温度,平衡向逆反应方向移动,混合气体总质量减小,总的物质的量不变,故混合气体的平均相对分子质量将减小,
故答案为:$\frac{{c}^{4}({H}_{2}O)}{{c}^{4}({H}_{2})}$;减小;
(3)①钢铁在中性或弱碱性环境中易发生吸氧腐蚀,
A.NaOH溶液,是碱溶液,发生吸氧腐蚀,故A正确;
B.C2H5OH是非电解质不能导电,不能形成原电池反应,故B错误;
C.NaCl溶液是中性电解质溶液,钢铁在其中发生吸氧腐蚀,故C正确;
D.稀硫酸是酸,在酸溶液中发生析氢腐蚀,故D错误;
故答案为:AC;
②铁在潮湿的空气中发生吸氧腐蚀时,正极上是氧气得电子的过程,电极反应为:O2+2H2O+4e-=4OH-,
故答案为:2H2O+O2+4e-=4OH-.
点评 本题考查了化学反应能量变化图象分析判断,反应活化能和焓变的理解应用,原电池原理和电解反应书写方法,掌握基础是关键,题目难度中等.

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案| A. | SO2和FeSO4溶液使酸性高锰酸钾的紫色退去 | |
| B. | Cl2和SO2都能使品红溶液褪色 | |
| C. | 常温下铁和金都不溶于浓硝酸 | |
| D. | 漂白粉和水玻璃长期暴露会变质 |
| A. | 混合气体中N0的物质的量为0.01mol | |
| B. | 混合气体中N02的物质的量为0.02mol | |
| C. | 稀硝酸的浓度为0.045mol/L | |
| D. | 氢氧化钠溶液的浓度为0.1mol/L |
| A. | 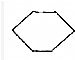 和 和 | B. | 金刚石和石墨 | ||
| C. | H3C-O-CH3和CH3CH2OH | D. |  和 和 |
| A. | 阳极附近溶液呈红色 | B. | 阳极逸出气体 | ||
| C. | 阴极附近溶液呈蓝色 | D. | 溶液的PH变大 |




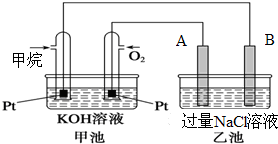 如图所示是甲烷燃料电池工作时的装置,乙池中的两个电极一个是石墨电极,一个是铜电极,工作时A、B两个电极的质量都不减少,请回答下列问题:
如图所示是甲烷燃料电池工作时的装置,乙池中的两个电极一个是石墨电极,一个是铜电极,工作时A、B两个电极的质量都不减少,请回答下列问题: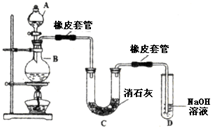 瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题:
瑞典化学家舍勒在研究软锰矿(主要成分是MnO2)的过程中,将它与浓盐酸混合加热,产生了一种黄绿色、刺激性气味的气体--氯气.某学生使用这一原理设计如图所示的实验装置,并且利用制得的氯气与潮湿的消石灰反应制取少量漂白粉(这是一个放热反应),据此回答下列问题: