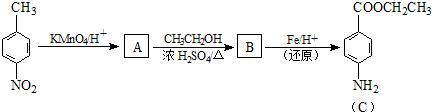
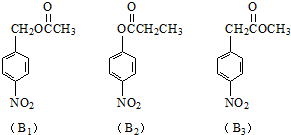
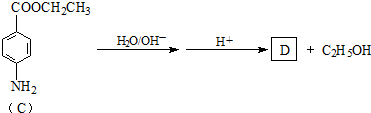
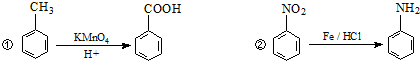题目内容
能与大量Fe3+共存的是( )
| A、Fe |
| B、S2- |
| C、Cu2+ |
| D、Cu |
考点:铁盐和亚铁盐的相互转变
专题:
分析:根据离子之间不能结合生成水、气体、沉淀、不能发生氧化还原反应等、不能相互促进水解等,则离子能大量共存,以此来解答.
解答:
解:A.Fe与Fe3+发生氧化还原反应生成二价铁离子,故A错误;
B.Fe3+具有较强的氧化性,S2-具有较强的还原性,发生氧化还原反应,不能共存,故B错误;
C.Fe3+与Cu2+离子之间不反应,能共存,故C正确;
D.Fe3+与Cu发生氧化还原反应,则不能共存,故D错误.
故选C.
B.Fe3+具有较强的氧化性,S2-具有较强的还原性,发生氧化还原反应,不能共存,故B错误;
C.Fe3+与Cu2+离子之间不反应,能共存,故C正确;
D.Fe3+与Cu发生氧化还原反应,则不能共存,故D错误.
故选C.
点评:本题考查离子的共存,明确习题中的信息是解答的关键,注意氧化还原及相互促进水解为解答的难点,题目难度中等.

练习册系列答案
 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A、向淀粉碘化钾溶液中加入氯水,溶液变为蓝色,可证明Cl2的氧化性强于I2 |
| B、新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,说明 Cl2有漂白性 |
| C、向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
| D、向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
根据部分短周期元素的原子半径及主要化合价信息,下列判断正确的是( )
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A、氢化物的沸点为H2T<H2R |
| B、单质分别与稀盐酸反应的速率:L<Q |
| C、L、M和R为同周期元素 |
| D、L2+与R2-的核外电子数相等 |
室温下,若溶液中由水电离产生c(OH-)=1×10-14 mol?L-1,满足此条件的溶液中一定可以大量共存的离子组是( )
| A、Al3+、Na+、NO3-、Cl- |
| B、K+、Na+、Cl-、AlO2- |
| C、K+、Na+、Cl-、NO3- |
| D、K+、NH4+、SO42-、NO3- |
以下各分子中,所有原子都满足最外层为8电子结构的是( )
| A、H3O+ |
| B、BF3 |
| C、P4 |
| D、PCl5 |
下列对分子的结构和性质的说法中,错误的是( )
| A、同碳原子数的醇分子中羟基数目越多,该物质就越易溶于水 |
B、乳酸 ( )分子中含有手性碳原子 )分子中含有手性碳原子 |
| C、白磷分子和甲烷分子均为正四面体,键角为109°28′ |
| D、H2CO3分子中的非羟基氧的个数为1,然而其酸性较弱,原因是溶于水的二氧化碳分子只有极少数与水结合成碳酸 |