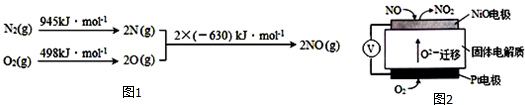题目内容
5.下列说法中,不正确的是( )| A. | 用渗析的方法制制氢氧化铁胶体 | |
| B. | SiO2、NaCl、I2、C2H6O均能真实表示物质分子组成 | |
| C. | ${\;}_{8}^{18}$O2-离子结构示意图 | |
| D. | 冰酸酸、铝热剂、硫酸钡、SO2分别屈于酸、混合物、强电解质、非电解质 |
分析 A.氢氧化铁胶体不能透过半透膜;
B.由分子构成的物质,化学式可表示真实的分子;
C.O2-离子原子核外有10个电子,最外层电子数为8;
D.硫酸钡为强酸强碱盐,难溶于水,但溶于水的部分完全电离.
解答 解:A.氢氧化铁胶体不能透过半透膜,则用渗析的方法精制氢氧化铁胶体,故A正确;
B.二氧化硅为原子晶体,由原子构成,NaCl为离子晶体,由离子构成,不存在分子,故B错误;
C.O2-离子原子核外有10个电子,最外层电子数为8,离子结构示意图为 ,故C正确;
,故C正确;
D.硫酸钡为强酸强碱盐,难溶于水,但溶于水的部分完全电离,为强电解质,故D正确.
故选B.
点评 本题考查内容较多,为高频考点,涉及胶体、晶体类型、原子结构示意图以及物质的分类等知识,注意明确强弱电解质的概念,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
15.下列说法正确的是( )
| A. | 工业上用二氧化硅在高温下与焦炭反应,生成单质硅和二氧化碳的原理,制取粗硅 | |
| B. | 手指不慎被玻璃划伤流血,可向伤口上涂FeCl3溶液,是因为FeCl3溶液可杀菌消毒 | |
| C. | 2014年山东莱芜共出现284天雾霾天气,对煤进行液化和气化等物理变化的处理,可减少雾霾天气的发生 | |
| D. | 白酒放置一定时间香味更浓,是因为白酒中乙醇与少量的有机酸反应生成有香味的酯 |
13.(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下
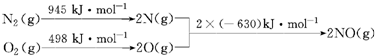
写出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+183KJ/mol.
(2)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
(3)工业上用高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g),该反应的反应热△H=+236KJ/molkJ/mol.(1 molSi有2molSi-Si)
(3)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)═3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)═6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)═P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)═CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,△H=△H1+3△H2+18△H3.
(4)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H1=+64.39kJ•mol-1
②2H2O2(l)═2H2O(l)+O2(g)△H2=-196.46kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.84kJ•mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol.

写出该反应的热化学方程式:N2(g)+O2(g)=2NO(g)△H=+183KJ/mol.
(2)通常人们把拆开1mol某化学键所吸收的能量看成该化学键的键能.键能的大小可以衡量化学键的强弱,也可以估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差.
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(3)由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)═3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)△H
已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)═6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g)△H1
2Ca3(PO4)2(s)+10C(s)═P4(g)+6CaO(s)+10CO(g)△H2
SiO2(s)+CaO(s)═CaSiO3(s)△H3
用△H1、△H2和△H3表示△H,△H=△H1+3△H2+18△H3.
(4)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
①Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H1=+64.39kJ•mol-1
②2H2O2(l)═2H2O(l)+O2(g)△H2=-196.46kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.84kJ•mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为Cu(s)+H2O2(l)+2H+(aq)=Cu2+(aq)+2H2O(l)△H=-319.6KJ/mol.
20.已知断开或形成1mol化学键吸收或放出的能量称为化学键的键能,如H-H键的键能为436kJ•mol-1,N≡N键的键能为945kJ•mol-1,N-H键的键能为391kJ•mol-1.则下列有关工业合成氨反应的热化学方程式正确的是
( )
( )
| A. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-93 kJ•mol-1 | |
| B. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=+1471 kJ•mol-1 | |
| C. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=+93 kJ•mol-1 | |
| D. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-1471 kJ•mol-1 |
10.有关实验的叙述,正确的是( )
| A. | 用瓷坩埚熔融氢氧化钠或碳酸钠 | |
| B. | 用玻璃棒蘸取溶液,点在湿润的pH试纸上测定溶液的pH值 | |
| C. | 用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 | |
| D. | 读取量筒内溶液液体的体积,俯视读数导致读数偏大 |
17.将新制氯水注入KI溶液中充分反应后,再加CCl4,振荡后静置,看到的现象是( )
| A. | 液体均一,呈紫红色 | |
| B. | 液体分两层,上层为紫红色,下层为无色 | |
| C. | 液体分两层,上层为无色,下层为紫红色 | |
| D. | 液体均一,呈无色 |
15.在25℃时,将两个铂电极插入一定量饱和Na2SO4溶液中进行电解,通电一段时间后,在阳极上放出ɑ mol气体,同时有w g Na2SO4•10H2O晶体析出.若温度不变,此时剩余溶液中溶质的质量分数为( )
| A. | $\frac{100w}{w+18a}$% | B. | $\frac{7100w}{161(w+18a)}$% | C. | $\frac{100w}{w+36a}$% | D. | $\frac{7100w}{161(w+36a)}$% |