题目内容
8. 工业上有一种用C02来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol.
工业上有一种用C02来生产甲醇燃料的方法:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol.(1)a点正反应速率大于(填“大于”“等于”或“小于”)逆反应速率.
(2)下列时间段平均反应速率最大的是A.
A.O~1min B.1~3min C.3~8min D.8~11min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中所示(虚线).曲线I对应的实验条件改变是升高温度,曲线Ⅱ对应的实验条件改变是增大压强,体积不变再充入3molCO2和4mol H2,H2O(g)的体积分数增大(填“增大”“不变”或“减小”).
(4)若将1molCO2和3molH2充入该容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为$\frac{1-a}{2}$.
分析 (1)a点时还没有达到平衡状态,从反应物的物质的量的变化趋势判断反应进行的方向,依次判断正逆反应速率大小;
(2)根据曲线的斜率判断,斜率越大,说明在单位时间内反应物的变化率越大,反应速率越大,也可分别计算不同时间内的反应速率大小来进行比较;
(3)从虚线变化判断达到平衡时反应物的转化的物质的量来分析,曲线I反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动,曲线Ⅲ反应速率增大,转化的氢气的物质的量多,平衡正向移动,应是增大压强;
(4)结合化学平衡三段式列式计算,气体压强之比等于气体物质的量之比计算得到.
解答 解:(1)a点时还没有达到平衡状态,反应物氢气的物质的量继续减小,平衡向正向移动,所以正反应速率大于逆反应速率,故答案为:大于;
(2)由图可知,
A.0~1min内氢气的变化量为8mol-6mol=2mol;
B.1~3min内氢气的变化量为6mol-3mol=3mol,平均1min变化量为1.5mol;
C.3~8min内氢气的变化量为3mol-2mol=1mol,平均1min变化量为0.2mol;
D.8~11min达平衡状态,氢气的物质的量不再变化.
故1~3min速率增大.
故答案为:A;
(3)曲线I反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动,不利于氢气的转化,故曲线I是升高温度;曲线Ⅲ反应速率增大,转化的氢气的物质的量多,因增大压强平衡正向移动,故应是增大压强,体积不变再充入3molCO2和4mol H2,相当于增大压强,平衡正向移动,则H2O(g)的体积分数增大,
故答案为:升高温度;增大压强;增大;
(4)在T1度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,
CO2(g)+3H2(g)=CH2OH(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol) a 3a a a
平衡量(mol) 1-a 3-3a a a
容器内的压强与起始压强之比=(4-2a):4=$\frac{1-a}{2}$,
故答案为:$\frac{1-a}{2}$.
点评 本题考查化学反应速率、平衡的图象以及化学平衡的计算,为高考常见题型和高频考点,侧重于学生的分析、计算能力的考查,注意把握对题目图象的分析.题目较为综合,具有一定难度.

| A. |  | B. |  | ||
| C. |  | D. |  |
| A. | ①④ | B. | ②⑤⑥ | C. | ①④⑤ | D. | ②③⑥ |
| A. | 反应中硫酸做还原剂,有铜被还原 | |
| B. | NH4CuSO3中硫元素被氧化 | |
| C. | 2mol NH4CuSO3完全反应转移6.02×1023个电子 | |
| D. | 刺激性气味的气体是氨气 |
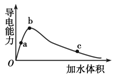 一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.
一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示.则下列说法错误的是( )
| A. | 醋酸的电离程度:a<b<c | |
| B. | 溶液的pH值:b<a<c | |
| C. | 蘸取a点溶液滴在湿润的pH试纸上,测得pH值一定偏大 | |
| D. | 若分别取a、b、c三点的溶液各10 mL,各用同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a>b>c |
| A. | 常温下将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 | |
| B. | 用蒸馏水润湿的试纸测溶液的pH,一定会使结果偏低 | |
| C. | 25℃时,用醋酸溶液滴定等浓度的NaOH溶液至pH=7,V醋酸>VNaOH | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液呈中性 |
CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g).
在130℃和180℃时,分别将0.50mol CH4和a mol NO2充入1L的密闭容器中发生反应,测得有关数据如表:
| 实验编号 | 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
(2)由表中数据分析可知,该反应的△H<0(填“=”、“>”或“<”),130℃和180℃平衡常数的关系:K(130℃)>K(180℃)(填“=”、“>”或“<”).
(3)如图1所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜.
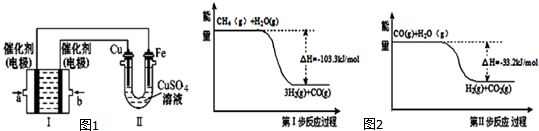
①a电极上发生反应的电极反应式是CH4+10OH--8e-=CO32-+7H2O.
②电镀结束后,装置Ⅰ中溶液的pH减小(填“增大”、“减小”或“不变”).
③若完全反应后,装置Ⅱ中Cu极质量减少12.8g,则装置Ⅰ中理论上消耗甲烷1.12L(标准状况下).
(4)用甲烷制取氢气的反应分为两步,其能量变化如图2所示:
写出甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5 kJ/mol.