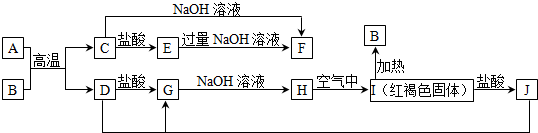
题目内容
18.下列物质中,属于电解质的是③;属于非电解质的是②;不属于电解质,但水溶液能导电的是④ ①Cu ②C2H5OH ③CaCO3 ④Cl2.分析 水溶液中或熔融状态下能够导电的化合物称为电解质,酸、碱、盐都是电解质;在上述两种情况下都不能导电的化合物称为非电解质,蔗糖、乙醇等都是非电解质.大多数的有机物都是非电解质;单质,混合物既不是电解质也不是非电解质;物质导电有两种原因,一是金属类有自由移动的电子能够导电,二是能够产生自由离子的溶液能够导电.
解答 解:①.铜是金属单质,所以铜既不是电解质也不是非电解质,能导电,其不溶于水不能够导电;
②.乙醇是以分子的形式分散在水中形成的溶液不能导电,不属于电解质,属非电解质;乙醇是有机共价化合物,水溶液中导致不会形成自由移动的离子,而无法导电;
③.碳酸钙是盐,在水溶液中虽难溶,但熔化状态下都能完全电离,CaCO3═Ca2++CO32-有自由移动的离子,能导电,是电解质,其水溶液几乎不导电;
④.氯气是单质,所以氯气既不是电解质也不是非电解质,氯气溶于水反应生成盐酸和次氯酸溶液导电;
属于电解质的是③,属于非电解质的为②,不属于电解质但水溶液能导电的为④,
故答案为:③;②;④.
点评 本题较简单,主要考查电解质的定义,熟悉常见的酸、碱、盐都属于电解质来解答,注意导电,要从导电实质的角度去分析给定物质是否具备导电性能.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
18.下列关于烃的性质描述中正确的是( )
| A. | 实验室可用H2除去乙烷中的乙烯 | |
| B. | 在催化剂作用下,苯与溴水反应生成溴苯,发生了反应 | |
| C. | 乙烯结构中含有碳碳双键,苯中不含碳碳双键,但二者均可发生加成反应 | |
| D. | C2H6与Cl2发生取代反应,C2H4与HCl发生加成反应,均可得到纯净的C2H5Cl |
19.下列图示实验正确的是( )
| A. | 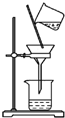 除去粗盐溶液中的不溶物(滤纸未画出) | |
| B. | 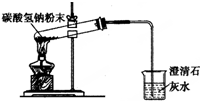 碳酸氢钠受热分解 | |
| C. | 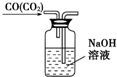 除去CO中的CO2 | |
| D. | 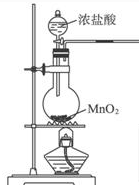 制取氯气 |
13.实验探究是体验知识的产生和形成过程的基本途径.下面是某同学完成的探究实验报告的一部分:
实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
请回答:
(1)完成该实验需用到的实验仪器是试管、胶头滴管;CCl4在实验中所起的作用是萃取剂.
(2)实验步骤②和③涉及离子方程式分别:②Cl2+2Br-=Br2+2Cl- ③Cl2+2I-=I2+2Cl-
(3)该同学的实验设计不足之处是没有比较Br2和I2的氧化性强弱,改进的办法是把第③步改为:KI溶液+溴水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色.
实验名称:卤素单质的氧化性强弱比较
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
请回答:
| 实验步骤 | 实验结论 |
| ①氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | 氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mL CCl4,振荡,静置,观察四氯化碳层颜色 |
(2)实验步骤②和③涉及离子方程式分别:②Cl2+2Br-=Br2+2Cl- ③Cl2+2I-=I2+2Cl-
(3)该同学的实验设计不足之处是没有比较Br2和I2的氧化性强弱,改进的办法是把第③步改为:KI溶液+溴水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色.
3.将质量相等的下列物质用乙酸完全酯化时,消耗乙酸质量最多的是( )
| A. | 乙二醇 | B. | 甘油 | C. | 甲醇 | D. | 乙醇 |
10.在一定温度下,对于可逆反应A(g)+2B(g)?3C(g),已达到平衡的标志是( )
| A. | C生成的速率与C分解的速率相等 | |
| B. | 单位时间内生成a mol A,同时生成2a mol B | |
| C. | 容器内各组分的总质量不再变化 | |
| D. | 混合气体的总物质的量不再变化 |
7.若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化.在变化的各阶段被破坏的粒子间的主要相互作用依次是( )
| A. | 氢键 分子间作用力 非极性键 | B. | 氢键 氢键 极性键 | ||
| C. | 氢键 极性键 分子间作用力 | D. | 分子间作用力 氢键 非极性键 |
8.某环境网站的一幅图如下,有关说法正确的( )
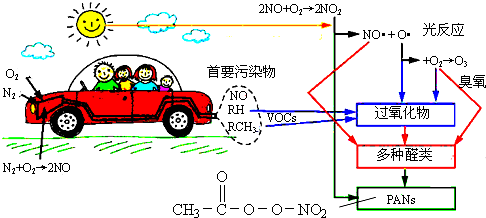

| A. | 汽车尾气中的NO、碳氢化合物(图中RH和RCH3)均来自燃油 | |
| B. | 醛类、PANs(过氧乙酰硝酸酯)均属于无机物 | |
| C. | O3污染、硝酸型酸雨及雾霾均与汽车尾气排放无关 | |
| D. | 汽车启动后,气缸内温度越高,单位时间内NO排放量越大,原因之一是N2与O2的反应速率加快 |