题目内容
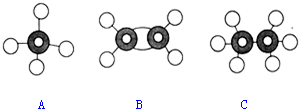
19.下列图示实验正确的是( )| A. | 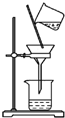 除去粗盐溶液中的不溶物(滤纸未画出) | |
| B. | 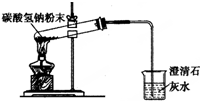 碳酸氢钠受热分解 | |
| C. | 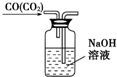 除去CO中的CO2 | |
| D. | 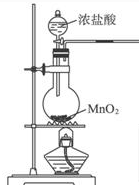 制取氯气 |
分析 A.过滤时漏斗下端应紧靠烧杯内壁;
B.碳酸氢钠受热分解有水生成;
C.除杂时导管应长进短出;
D.浓盐酸与二氧化锰加热反应生成氯气.
解答 解:A.过滤时遵循一贴、二低、三靠,漏斗下端应紧靠烧杯内壁,操作不合理,故A错误;
B.碳酸氢钠受热分解有水生成,则试管口应略向下倾斜,故B错误;
C.除杂时导管应长进短出,图中导管的进气方向不合理,故C错误;
D.浓盐酸与二氧化锰加热反应生成氯气,制备原理及装置合理,故D正确;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、实验装置的作用、实验技能等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
9.化学科学需要借助化学专用语言来描述,下列有关化学用语正确的是( )
| A. | 原子核内有10个中子的氧原子818O | B. | 乙烯的结构简式为:C2H4 | ||
| C. | CH4分子的比例模型: | D. | -CH3(甲基)的电子式为: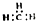 |
10.用括号内的试剂和分离方法,除去下列物质中的少量杂质,正确的是( )
| A. | 乙醇中的水(生石灰,蒸馏) | B. | 乙烷中的乙烯(酸性KMnO4溶液,洗气) | ||
| C. | 溴苯中的溴(KI溶液,分液) | D. | 乙酸乙酯中的乙酸(NaOH溶液,蒸馏) |
14.有agNaHCO3和NaOH的混合物,混合物中含钠的质量分数为46%,将其放在密闭容器中加热,下列关于混合加热前后消耗盐酸的物质的量的判断正确的是( )
| A. | 加热前消耗的多 | |
| B. | 加热后消耗的多 | |
| C. | 加热前后均消耗0.02amolHCl | |
| D. | 当n(NaOH)>n(NaHCO3)时消耗的才会一样多 |
1.现有下列短周期元素性质的数据:
试回答下列问题:
(1)元素③在周期表中的位置是第二周期IA族;元素④与元素⑦相比较,气态氢化物较稳定的是NH3.
(2)元素①与元素⑥按照原子个数比为1:1形成的化合物中化学键的类型为离子键、共价键.
(3)Y和Z均由元素①组成,反应Y+2I-+2H+═I2+Z+H2O常作为Y的鉴定反应.
Ⅰ.Y与Z的关系是(选填字母)b.
a.同位素 b.同素异形体 c.同系物 d.同分异构体
Ⅱ.将Y和二氧化硫分别通入品红溶液,都能使品红褪色.简述用褪色的溶液区分二者的实验方法:加热褪色后的溶液,若溶液恢复红色,则原通入气体为SO2,若溶液不变红,则原通入气体是O3.
(4)元素⑤的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式:Cl2O7(l)+H2O(l)═2HClO4(aq)△H=-4QkJ/mol.
(5)元素①单质和元素⑧单质在海水中可以形成原电池,写出正极反应式:O2+4e-+2H2O═4OH-.
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径 (10-10m) | 0.73 | 1.02 | 1.34 | 1.06 | 0.99 | .5 4 | 0.75 | 1.18 |
| 最高或最 低化合价 | +6 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -2 | -3 | -1 | -3 |
(1)元素③在周期表中的位置是第二周期IA族;元素④与元素⑦相比较,气态氢化物较稳定的是NH3.
(2)元素①与元素⑥按照原子个数比为1:1形成的化合物中化学键的类型为离子键、共价键.
(3)Y和Z均由元素①组成,反应Y+2I-+2H+═I2+Z+H2O常作为Y的鉴定反应.
Ⅰ.Y与Z的关系是(选填字母)b.
a.同位素 b.同素异形体 c.同系物 d.同分异构体
Ⅱ.将Y和二氧化硫分别通入品红溶液,都能使品红褪色.简述用褪色的溶液区分二者的实验方法:加热褪色后的溶液,若溶液恢复红色,则原通入气体为SO2,若溶液不变红,则原通入气体是O3.
(4)元素⑤的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量.写出该反应的热化学方程式:Cl2O7(l)+H2O(l)═2HClO4(aq)△H=-4QkJ/mol.
(5)元素①单质和元素⑧单质在海水中可以形成原电池,写出正极反应式:O2+4e-+2H2O═4OH-.
19.合成氨工业对国民经济和社会发展具有重要的意义.哈伯法合成氨需要在20-50MPa的高压和500℃的高温下,并用铁作为催化剂,氨的转化率为10%-15%.最近美国俄勒冈大学的化学家使用了一种名为trans-Fe(DMeOPrPE)2的催化剂,在常温下合成出氨,反应方程式可表示为N2+3H2→2NH3,有关说法正确的是( )
| A. | 哈伯法合成氨是吸热反应,新法合成氨是放热反应 | |
| B. | 新法合成和哈伯法相比不需要在高温条件下,可节约大量能源,具有发展前景 | |
| C. | 新法合成能在常温下进行是因为不需要断裂化学键 | |
| D. | 新的催化剂升高了反应所需要的能量,提高了活化分子百分数 |