题目内容
3.将质量相等的下列物质用乙酸完全酯化时,消耗乙酸质量最多的是( )| A. | 乙二醇 | B. | 甘油 | C. | 甲醇 | D. | 乙醇 |
分析 若某醇质量为1 g,该醇相对分子质量为Mr,该醇分子中含有x个羟基.则1 g该醇含羟基(也即酯化时需羧基或醋酸)的物质的量为:$\frac{1}{M}$×x=$\frac{x}{M}$,比较4种醇中的$\frac{x}{M}$值,即可判断出正确答案.
解答 解:若某醇质量为1 g,该醇相对分子质量为Mr,该醇分子中含有x个羟基,则1 g该醇含羟基(也即酯化时需羧基或醋酸)的物质的量为:$\frac{1}{M}$×x=$\frac{x}{M}$,
A.乙二醇消耗乙酸为:$\frac{2}{62}$mol=$\frac{1}{31}$mol;
B.甘油消耗乙酸为:$\frac{3}{92}$mol;
C.甲醇消耗乙酸为:$\frac{1}{32}$mol;
乙醇消耗乙酸为:$\frac{1}{46}$mol,
可见相等质量的4种醇中,甘油酯化消耗的醋酸最多,
故选B.
点评 本题考查化学方程式的有关计算,明确酯化反应原理为解答关键,注意利用常见有机物通式进行解答,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
3.活性炭可处理大气污染物NO.T℃时,在1L密闭容器中加入NO气体和炭粉,发生反应生成两种气体A和B,测得各物质的物质的量如下:
(1)2min内,用NO表示该反应的平均速率v(NO)=0.03mol•L-1•min-1.
(2)该反应的化学方程式是C+2NO?N2+CO2.
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是②④.
①v(NO):v(A):v(B)=2:1:1
②混合气体的密度不再改变
③总压强不再改变
④混合气体的平均相对分子质量不再改变
 (4)碳元素可形成数量众多,分布极广的有机化合物,其中甲醇是常见的燃料,甲醇燃料电池的结构示意图如下,一极通入甲醇,另外一极通入氧气;电解质溶液是稀硫酸,电池工作时总反应式:2CH3OH+3O2=2CO2+4H2O.
(4)碳元素可形成数量众多,分布极广的有机化合物,其中甲醇是常见的燃料,甲醇燃料电池的结构示意图如下,一极通入甲醇,另外一极通入氧气;电解质溶液是稀硫酸,电池工作时总反应式:2CH3OH+3O2=2CO2+4H2O.
①a处通入的物质是CH3OH,电极反应式为:CH3OH-6e-+H2O=CO2+6H+;
②b处电极反应式为3O2+12e-+12H+=6H2O;
③电池工作时H+由负极移向正极(填正、负极).
| 活性炭/mol | NO/mol | A/mol | B/mol | |
| 起始状态 | 2.030 | 0.100 | 0 | 0 |
| 2min时 | 2.000 | 0.040 | 0.030 | 0.030 |
(2)该反应的化学方程式是C+2NO?N2+CO2.
(3)一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是②④.
①v(NO):v(A):v(B)=2:1:1
②混合气体的密度不再改变
③总压强不再改变
④混合气体的平均相对分子质量不再改变
 (4)碳元素可形成数量众多,分布极广的有机化合物,其中甲醇是常见的燃料,甲醇燃料电池的结构示意图如下,一极通入甲醇,另外一极通入氧气;电解质溶液是稀硫酸,电池工作时总反应式:2CH3OH+3O2=2CO2+4H2O.
(4)碳元素可形成数量众多,分布极广的有机化合物,其中甲醇是常见的燃料,甲醇燃料电池的结构示意图如下,一极通入甲醇,另外一极通入氧气;电解质溶液是稀硫酸,电池工作时总反应式:2CH3OH+3O2=2CO2+4H2O.①a处通入的物质是CH3OH,电极反应式为:CH3OH-6e-+H2O=CO2+6H+;
②b处电极反应式为3O2+12e-+12H+=6H2O;
③电池工作时H+由负极移向正极(填正、负极).
11.乙醇在人体内的代谢过程如下:
CH3CH2OH$→_{①}^{乙醇脱氢酶}$CH3CHO$→_{②}^{乙醛脱氢酶}$CH3COOH$→_{③}^{枸橼酸循环}$CO2+H2O
而双硫仑(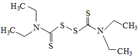 )会抑制肝脏中的乙醛脱氢酶,造成危害,严重的可能导致死亡.许多抗菌药(如:头孢)具有与双硫仑相似的作用,因此服用头孢后严禁饮酒.下列有关说法不正确的是( )
)会抑制肝脏中的乙醛脱氢酶,造成危害,严重的可能导致死亡.许多抗菌药(如:头孢)具有与双硫仑相似的作用,因此服用头孢后严禁饮酒.下列有关说法不正确的是( )
CH3CH2OH$→_{①}^{乙醇脱氢酶}$CH3CHO$→_{②}^{乙醛脱氢酶}$CH3COOH$→_{③}^{枸橼酸循环}$CO2+H2O
而双硫仑(
 )会抑制肝脏中的乙醛脱氢酶,造成危害,严重的可能导致死亡.许多抗菌药(如:头孢)具有与双硫仑相似的作用,因此服用头孢后严禁饮酒.下列有关说法不正确的是( )
)会抑制肝脏中的乙醛脱氢酶,造成危害,严重的可能导致死亡.许多抗菌药(如:头孢)具有与双硫仑相似的作用,因此服用头孢后严禁饮酒.下列有关说法不正确的是( )| A. | “双硫仑”分子式为C10H12N2S4,在水中的溶解度较小 | |
| B. | 反应①②均属于氧化反应 | |
| C. | 一个人的酒量大小取决于体内上述两种酶的多少 | |
| D. | 乙醛是对人体有害的物质,含官能团名称为“醛基” |
15.下列说法不正确的是( )
| A. | 有些活泼金属如钠、镁、铝可作热还原法的还原剂 | |
| B. | 用电解熔融NaCl的方法来冶炼金属钠 | |
| C. | 回收废旧金属可以重新制成金属或它们的化合物 | |
| D. | 可用焦炭或一氧化碳还原氧化铝的方法来冶炼铝 |
12.某学生利用以下装置探究氯气与氨气之间的反应.其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置.
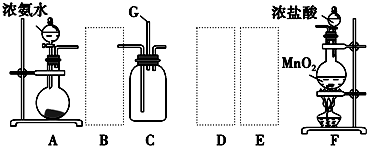
请回答下列问题:
(1)装置F中发生反应的离子方程式:MnO2+4H++2C1-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++C12↑+2H2O.
(2)装置A中的烧瓶内固体可选用ABE(选填以下选项的代号).
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:
BⅠ,DⅡ,EⅢ.(均填编号)
(4)从装置C的出气管口处逸出的尾气可能含有污染环境的有毒气体,如何处理?氢氧化钠溶液吸收.原理是(用化学方程式表示):Cl2+2NaOH=NaCl+NaClO+H2O.

| Ⅰ | Ⅱ | Ⅲ | |
| 备选装置 |  |  |  |
(1)装置F中发生反应的离子方程式:MnO2+4H++2C1-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++C12↑+2H2O.
(2)装置A中的烧瓶内固体可选用ABE(选填以下选项的代号).
A.碱石灰 B.生石灰 C.二氧化硅 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从上图的备选装置中选择,并将编号填入下列空格:
BⅠ,DⅡ,EⅢ.(均填编号)
(4)从装置C的出气管口处逸出的尾气可能含有污染环境的有毒气体,如何处理?氢氧化钠溶液吸收.原理是(用化学方程式表示):Cl2+2NaOH=NaCl+NaClO+H2O.
13.高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压,高铁电池的总反为:3Zn+2K2FeO4+8H2O$?_{充电}^{放电}$3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
| A. | 放电时负极反应式为:Zn-2e-+2OH-=Zn(OH)2 | |
| B. | 放电时每转移3mol电子,正极有1 mol K2FeO4被还原 | |
| C. | 充电时阴极附近溶液的碱性增强 | |
| D. | 放电时正极反应式为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O |