题目内容
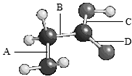 如图是氨基乙酸的球棍模型(图中的“棍”可能是单键,也可能是双键),该分子由四种元素的原子构成,它们原子半径的大小顺序是:X>Y>Z>W.
如图是氨基乙酸的球棍模型(图中的“棍”可能是单键,也可能是双键),该分子由四种元素的原子构成,它们原子半径的大小顺序是:X>Y>Z>W.(1)根据上图的模型,写出该分子的结构简式
a.离子晶体b.分子晶体c.原子晶体d.金属晶体
(2)Y与W可形成YW5的化合物,有关该物质的叙述正确的是
A.共价化合物,固态时是分子晶体 B.溶于水所形成的溶液显碱性 C.YW5与盐酸反应生成一种盐 D.投入少量水中,有一种气体产生
(3)下列可以验证Y与Z两元素原子得电子能力强弱的实验事实是
A.比较这两种元素的气态氢化物的沸点B.比较这两种元素最高价氧化物对应水化物的酸性C.比较这两种元素的气态氢化物的还原性D.比较这两种元素的单质的活泼性E.一定条件下,Z单质可以将Y单质从氢化物中置换出来
(4)X和W两元素组成的分子构型可能是
A.直线形B.平面形C.三角锥形D.正四面体
(5)X、Y、Z、W四种元素组成的某无机盐,既可与盐酸反应,又可以与NaOH溶液反应,其化学式为
(6)Si与Al、Be具有相似的化学性质,因为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:根据图中氨基乙酸的球棍模型,以及原子成键特点知,A、B、C处都是单键,D处是双键;所含元素有C、H、O、N,它们原子半径的大小顺序是:X>Y>Z>W,原子电子层数越多其原子半径越大,同一周期元素,其原子半径随着原子序数增大而减小,所以X是C元素、Y是N元素、Z是O元素、W是H元素,据此答题.
解答:
解:根据图中氨基乙酸的球棍模型,以及原子成键特点知,A、B、C处都是单键,D处是双键;所含元素有C、H、O、N,它们原子半径的大小顺序是:X>Y>Z>W,原子电子层数越多其原子半径越大,同一周期元素,其原子半径随着原子序数增大而减小,所以X是C元素、Y是N元素、Z是O元素、W是H元素,
(1)根据上图的模型可知该分子的结构简式为NH2CH2COOH;最外层有两个未成对电子的是O;Z为氧元素,原子的最外层共有6个电子,分布在s轨道和p轨道,所以有2种不同能量的电子,X为碳元素,形成的单质晶体不可能为离子晶体和金属晶体,故选ad,
故答案为:NH2CH2COOH;O;2;ad;
(2)Y与W可形成YW5的化合物为NH4H,
A.NH4H为离子化合物,固态时是离子晶体,故A错误;
B.溶于水时,和水反应生成一水合氨和氢气,所以所形成的溶液显碱性,故B正确
C.YW5与盐酸反应生成一种盐为氯化铵和氢气,故C正确;
D.溶于水时生成一水合氨和氢气,一水合氨不稳定,分解生成氨气,所以投入少量水中,有两种气体产生,故D错误;
故选BC;
(3)Y是N元素、Z是O元素,验证N与O两元素原子得电子能力强弱方法有:其最高价氧化物的水化物酸性强弱、其气态氢化物的稳定性强弱、和氢气化合难易程度、单质的氧化性、气态氢化物的还原性等,但O元素没有含氧酸,
故选CE;
(4)C和H两元素组成的分子构型可能是直线形,例如乙炔,也可能是平面形,例如乙烯,也可能是正四面体,例如甲烷,
故选ABD;
(5)X、Y、Z、W四种元素组成的某无机盐,既可与盐酸反应,又可以与NaOH溶液反应,为弱酸的铵盐,如碳酸铵或碳酸氢铵;在这四种元素中,一种元素的单质在加热时能够与另外三种元素组成的具有强氧化性的化合物反应,该反应为C和浓硝酸的反应,反应方程式为;C+4HNO3(浓)
CO2↑+4NO2+2H2O,
故答案为:NH4HCO3、(NH4)2CO3;C+4HNO3(浓)
CO2↑+4NO2+2H2O;
(6)Si与Al、Be具有相似的化学性质,因为它们都在周期表中金属和非金属的分界线附近,
故答案为:Si与Al、Be都在周期表中金属和非金属的分界线附近.
(1)根据上图的模型可知该分子的结构简式为NH2CH2COOH;最外层有两个未成对电子的是O;Z为氧元素,原子的最外层共有6个电子,分布在s轨道和p轨道,所以有2种不同能量的电子,X为碳元素,形成的单质晶体不可能为离子晶体和金属晶体,故选ad,
故答案为:NH2CH2COOH;O;2;ad;
(2)Y与W可形成YW5的化合物为NH4H,
A.NH4H为离子化合物,固态时是离子晶体,故A错误;
B.溶于水时,和水反应生成一水合氨和氢气,所以所形成的溶液显碱性,故B正确
C.YW5与盐酸反应生成一种盐为氯化铵和氢气,故C正确;
D.溶于水时生成一水合氨和氢气,一水合氨不稳定,分解生成氨气,所以投入少量水中,有两种气体产生,故D错误;
故选BC;
(3)Y是N元素、Z是O元素,验证N与O两元素原子得电子能力强弱方法有:其最高价氧化物的水化物酸性强弱、其气态氢化物的稳定性强弱、和氢气化合难易程度、单质的氧化性、气态氢化物的还原性等,但O元素没有含氧酸,
故选CE;
(4)C和H两元素组成的分子构型可能是直线形,例如乙炔,也可能是平面形,例如乙烯,也可能是正四面体,例如甲烷,
故选ABD;
(5)X、Y、Z、W四种元素组成的某无机盐,既可与盐酸反应,又可以与NaOH溶液反应,为弱酸的铵盐,如碳酸铵或碳酸氢铵;在这四种元素中,一种元素的单质在加热时能够与另外三种元素组成的具有强氧化性的化合物反应,该反应为C和浓硝酸的反应,反应方程式为;C+4HNO3(浓)
| ||
故答案为:NH4HCO3、(NH4)2CO3;C+4HNO3(浓)
| ||
(6)Si与Al、Be具有相似的化学性质,因为它们都在周期表中金属和非金属的分界线附近,
故答案为:Si与Al、Be都在周期表中金属和非金属的分界线附近.
点评:本题主要考查了结构简式、原子结构、晶体的类型、元素化合物知识、元素周期表等知识,有一定的综合性,中等难度,解题的前提是元素推断,答题时注意有机知识的应用.

练习册系列答案
相关题目
CaH2常作为生氢剂,其中氢元素呈-1价,其化学方程式为CaH2+2H2O═Ca(OH)2+2H2↑,其中水是( )
| A、还原剂 |
| B、氧化剂 |
| C、既是还原剂又是氧化剂 |
| D、既不是氧化剂又不是还原剂 |
能用H++OH-=H2O表示的是( )
| A、NaOH溶液和CO2的反应 |
| B、Ba(OH)2溶液和稀H2SO4的反应 |
| C、NaOH溶液和盐酸反应 |
| D、氨水和盐酸的反应 |
下列表示溶液中发生反应的化学方程式错误的是( )
| A、100 mL 0.1 mol/L的Na2CO3溶液中加入0.01 mol CH3COOH:CO32-+CH3COOH═HCO3-+CH3COO- |
| B、向HCOOK和KOH混合溶液中加入KMnO4:2KMnO4+HCOOK+KOH═2K2MnO4+CO2 ↑+H2O |
| C、4mol/L 的NaAlO2溶液和7mol/L 的盐酸等体积均匀混合:4AlO2-+7H++H2O═3Al(OH)3↓+Al3+ |
| D、在含有Mn2+的溶液中加入HNO3、再加入PbO2,则反应体系显紫红色:5PbO2+2Mn2++4H+═5Pb2++2MnO4-+2H2O |
下列变化过程一定需要加入还原剂才能实现的是( )
| A、KClO3→KCl |
| B、CO2→C |
| C、Fe→Fe2+ |
| D、NaCl→HCl |