题目内容
Fe转化成Fe2+的离子方程式: ;Fe3+转换成Fe2+的离子方程式: .
考点:离子方程式的书写
专题:离子反应专题
分析:元素处于最高价态时,只有氧化性;处于最低价态时,只有还原性;处于中间价态时,则既有氧化性,又有还原性,据此联系具体反应书写离子反应方程式即可.
解答:
解:Fe与较弱的氧化剂HCl溶液反应生成氯化亚铁,离子反应方程式为:2H++Fe=Fe2++H2↑,Fe具有还原性,铁离子具有氧化性,向黄色的FeCl3溶液中加入铁粉可以实现的离子反应为2Fe3++Fe=3Fe2+,
故答案为:2H++Fe=Fe2++H2↑;2Fe3++Fe=3Fe2+.
故答案为:2H++Fe=Fe2++H2↑;2Fe3++Fe=3Fe2+.
点评:本题主要考查的是铁与其变价离子之间的相互转化,熟练记忆有关化合价的氧化性与还原性是解题关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列化学用语正确的是( )
A、乙酸根离子的结构式: |
| B、乙酸的结构简式C2H4O2 |
| C、3-甲基-1-丁烯的结构简式:(CH3)2CHCH═CH2 |
D、醛基的电子式: |
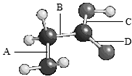 如图是氨基乙酸的球棍模型(图中的“棍”可能是单键,也可能是双键),该分子由四种元素的原子构成,它们原子半径的大小顺序是:X>Y>Z>W.
如图是氨基乙酸的球棍模型(图中的“棍”可能是单键,也可能是双键),该分子由四种元素的原子构成,它们原子半径的大小顺序是:X>Y>Z>W.