题目内容
在元素周期表中,某稀有气体元素原子的最外层电子构型为4s24p6,与其同周期的A、B、C、D四种元素,它们的原子最外层电子数依次为2、2、1、7.其中A、C两元素原子的次外层电子数为8,B、D两元素原子的次外层层电子数为18.E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点量高.
(1)B元素在周期表中的位置 ;D元素的价电子排布式为 .
(2)已知B离子类似Cu2+与NH3形成配合离子,且两者配位数也相同,1mol该配离子中含有 molσ键.
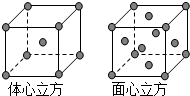
(3)A元素可与E元素形成离子化合物,它的晶胞如图1所示,E离子的配位数为 .每个A离子周围与之最近等距的A离子有 个.

(4)已知铜元素能形成多种化合物.
①CuSO4?5H2O也可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图2所示.下列说法正确的是 (填字母).
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.该晶体中电负性最大的元素是O
C.该晶体属于原子晶体
D.该晶体中的水在不同温度下会分步失去
②YBCD-12也是一种含Cu元素的化合物,化学式为YBa2Cu3O6.95.已知该化合物中各元素的化合价为:Y为+3价、Ba为+2价、O为-2价、Cu为+2价和+3价.则该化合物中+2价Cu和+3价Cu的原子个数之比为 .
(1)B元素在周期表中的位置
(2)已知B离子类似Cu2+与NH3形成配合离子,且两者配位数也相同,1mol该配离子中含有
(3)A元素可与E元素形成离子化合物,它的晶胞如图1所示,E离子的配位数为

(4)已知铜元素能形成多种化合物.
①CuSO4?5H2O也可写成[Cu(H2O)4]SO4?H2O,其结构示意图如图2所示.下列说法正确的是
A.在上述结构示意图中,所有氧原子都采用sp3杂化
B.该晶体中电负性最大的元素是O
C.该晶体属于原子晶体
D.该晶体中的水在不同温度下会分步失去
②YBCD-12也是一种含Cu元素的化合物,化学式为YBa2Cu3O6.95.已知该化合物中各元素的化合价为:Y为+3价、Ba为+2价、O为-2价、Cu为+2价和+3价.则该化合物中+2价Cu和+3价Cu的原子个数之比为
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:在元素周期表中,某稀有气体元素原子的最外层电子构型为4s24p6,为Kr元素,处于第四周期,与其同周期的A、B、C、D四种元素,它们的原子的最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,则A为Ca元素,C为K元素,B、D两元素原子的次外层电子数18,则B为Zn元素,D为Br元素,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高,则E为F元素,据此答题.
解答:
解:在元素周期表中,某稀有气体元素原子的最外层电子构型为4s24p6,为Kr元素,处于第四周期,与其同周期的A、B、C、D四种元素,它们的原子的最外层电子数依次为2、2、1、7,其中A、C两元素原子的次外层电子数为8,则A为Ca元素,C为K元素,B、D两元素原子的次外层电子数18,则B为Zn元素,D为Br元素,E、D两元素处于同族,且在该族元素中,E的气态氢化物的沸点最高,则E为F元素,
(1)B为Zn元素,外围电子排布为3d104s2,在周期表中的位置为第四周期ⅡB族;D为Br元素,价电子排布式为4s24p5,
故答案为:第四周期ⅡB族;4s24p5;
(2)已知B离子(Zn2+)类似Cu2+与NH3形成配合离子,且两者配位数也相同,即形成的配离子为[Zn(NH3)4]2+,锌离子与氨气分子之间形成4个配位键,氨气分子中含有N-H键,均为σ键,1mol该配离子中含有σ键为(4+4×3)mol=16mol,故答案为:16;
(3)Ca元素可与F元素形成离子化合物,晶胞中大球数目为8,小球数目=6×
+8×
=4,故大球为F-离子,小球为Ca2+离子,F-离子周围有4个Ca2+离子,F-离子的配位数为4,以顶点Ca2+离子研究,与之最近且等距离的Ca2+离子位于面心,每个顶点为12个面共用,故每个Ca2+离子周围与之最近等距的Ca2+离子有12个,故答案为:4;12;
(4)①A.硫酸根离子中氧原子并不都是sp3杂化,该结构中的氧原子部分饱和,部分不饱和,杂化方式不同,故A正确;
B.该晶体中O元素表现负化合价,故电负性最大的元素是O,故B正确;
C.由水合铜离子及硫酸根离子构成的,属于离子晶体该晶体,故C错误;
D.由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,因此受热时也会因温度不同而得到不同的产物,故D正确,
故答案为:BD;
②根据化合物各元素的化合价代数和为0确定铜的平均化合价,铜的平均化合价=
=2.3,利用十字相乘法确定+2价Cu和+3价Cu的原子个数之比,即 ,故所以+2价Cu和+3价Cu的原子个数之比=0.7:0.3=7:3,故答案为:7:3.
,故所以+2价Cu和+3价Cu的原子个数之比=0.7:0.3=7:3,故答案为:7:3.
(1)B为Zn元素,外围电子排布为3d104s2,在周期表中的位置为第四周期ⅡB族;D为Br元素,价电子排布式为4s24p5,
故答案为:第四周期ⅡB族;4s24p5;
(2)已知B离子(Zn2+)类似Cu2+与NH3形成配合离子,且两者配位数也相同,即形成的配离子为[Zn(NH3)4]2+,锌离子与氨气分子之间形成4个配位键,氨气分子中含有N-H键,均为σ键,1mol该配离子中含有σ键为(4+4×3)mol=16mol,故答案为:16;
(3)Ca元素可与F元素形成离子化合物,晶胞中大球数目为8,小球数目=6×
| 1 |
| 2 |
| 1 |
| 2 |
(4)①A.硫酸根离子中氧原子并不都是sp3杂化,该结构中的氧原子部分饱和,部分不饱和,杂化方式不同,故A正确;
B.该晶体中O元素表现负化合价,故电负性最大的元素是O,故B正确;
C.由水合铜离子及硫酸根离子构成的,属于离子晶体该晶体,故C错误;
D.由于胆矾晶体中水两类,一类是形成配体的水分子,一类是形成氢键的水分子,因此受热时也会因温度不同而得到不同的产物,故D正确,
故答案为:BD;
②根据化合物各元素的化合价代数和为0确定铜的平均化合价,铜的平均化合价=
| 6.95×2-3-2×2 |
| 3 |
 ,故所以+2价Cu和+3价Cu的原子个数之比=0.7:0.3=7:3,故答案为:7:3.
,故所以+2价Cu和+3价Cu的原子个数之比=0.7:0.3=7:3,故答案为:7:3.
点评:本题是对物质结构的考查,涉及核外电子排布、配合物、晶胞计算、复杂化学式有关计算等,利用均摊法进行晶胞有关计算,需要学生具有一定的空间想象与数学运算能力,难度中等.

练习册系列答案
相关题目
常温下,将pH=12的烧碱和pH=2乙酸溶液等体积混合,充分反应后溶液的pH ( )
| A、pH<7 | B、pH>7 |
| C、pH=7 | D、无法判断 |

 利用有关知识回答下列问题:
利用有关知识回答下列问题:
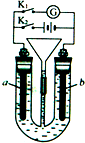 在如图所示装置中,U形管内装满稀H2SO4,a为铁电极,b为多孔石墨电极.
在如图所示装置中,U形管内装满稀H2SO4,a为铁电极,b为多孔石墨电极. 已知水在25℃和100℃时,其电离平衡曲线如图所示:
已知水在25℃和100℃时,其电离平衡曲线如图所示: