题目内容
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:| 方法a | 用炭粉在高温条件下还原CuO | ||||
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O; | ||||
| 方法c | 电解法,反应为2Cu+H2O
| ||||
| 方法d | 用肼(N2H4)还原新制的Cu(OH)2 |
| 1 |
| 2 |
C(s)+
| 1 |
| 2 |
Cu(s)+
| 1 |
| 2 |
(2)方法c采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示:该电池的阳极反应式为
(3)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为
(4)在相同的密闭容器中,用以上方法制得的三种Cu2O分别进行催化分解水的实验:2H2O(g)
| 光照 |
| Cu2O |
| 序号 | 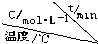 | 0 | 10 | 20 | 30 | 40 | 50 |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
A.实验的温度:T2<T1
B.实验②比实验①所用的催化剂催化效率高
C.实验①前20min的平均反应速率 v(H2)=7×10-5 mol?L-1 min-1.
考点:热化学方程式,化学平衡的影响因素,化学平衡的计算,电解原理
专题:
分析:(1)根据盖斯定律结合热化学方程式的书写方法来书写;
(2)在电解池的阳极发生失电子的氧化反应;钛极是阴极发生氢离子得电子的还原反应,据此分析附近pH值变化;
(3)根据“液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2”来书写化学方程式;
(4)A、根据温度对化学平衡移动的影响知识来回答;
B、催化剂不会引起化学平衡状态的改变,会使反应速率加快,活性越高,速率越快;
C、根据反应速率v=
来计算.
(2)在电解池的阳极发生失电子的氧化反应;钛极是阴极发生氢离子得电子的还原反应,据此分析附近pH值变化;
(3)根据“液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2”来书写化学方程式;
(4)A、根据温度对化学平衡移动的影响知识来回答;
B、催化剂不会引起化学平衡状态的改变,会使反应速率加快,活性越高,速率越快;
C、根据反应速率v=
| △c |
| △t |
解答:
解:(1)已知:①2Cu(s)+
O2(g)=Cu2O(s);△H=-169kJ?mol-1,
②C(s)+
O2(g)=CO(g);△H=-110.5kJ?mol-1,
③Cu(s)+
O2(g)═CuO(s)△H=-157kJ?mol-1
用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为C(s)+2CuO (s)=Cu2O(s)+CO(g)
该反应可以是②-③×2-
×①,反应的焓变是-110.5kJ?mol-1-(-157kJ?mol-1×2)-
×(-169kJ?mol-1)=34.5kJ?mol-1,
故答案为:C(s)+2CuO (s)=Cu2O(s)+CO(g)△H=+34.5kJ?mol-1;
(2)在电解池中,当阳极是活泼电极时,该电机本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O,钛极是阴极发生氢离子得电子的还原反应,所以消耗氢离子,则PH值增大,故答案为:2Cu-2e-+2OH-=Cu2O+H2O;增大;
(3)根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,得出化学方程式为:4Cu(OH)2+N2H4
2Cu2O+N2↑+6H2O,故答案为:4Cu(OH)2+N2H4
2Cu2O+N2↑+6H2O;
(4)A、实验温度越高达到化学平衡时水蒸气转化率越大,②和③相比,③转化率高所以T2>T1,故A错误;
B、①②化学平衡状态未改变,反应速率加快,则是加入了催化剂,催化剂的活性越高,速率越快,在相等时间内,②中水蒸气的浓度变化比①快,故B正确;
C、实验①前20min的平均反应速率 v(H2)=
=
=7×10-5 mol?L-1 min-1,故C正确;
故选BC.
| 1 |
| 2 |
②C(s)+
| 1 |
| 2 |
③Cu(s)+
| 1 |
| 2 |
用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为C(s)+2CuO (s)=Cu2O(s)+CO(g)
该反应可以是②-③×2-
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:C(s)+2CuO (s)=Cu2O(s)+CO(g)△H=+34.5kJ?mol-1;
(2)在电解池中,当阳极是活泼电极时,该电机本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O,钛极是阴极发生氢离子得电子的还原反应,所以消耗氢离子,则PH值增大,故答案为:2Cu-2e-+2OH-=Cu2O+H2O;增大;
(3)根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,得出化学方程式为:4Cu(OH)2+N2H4
| ||
| ||
(4)A、实验温度越高达到化学平衡时水蒸气转化率越大,②和③相比,③转化率高所以T2>T1,故A错误;
B、①②化学平衡状态未改变,反应速率加快,则是加入了催化剂,催化剂的活性越高,速率越快,在相等时间内,②中水蒸气的浓度变化比①快,故B正确;
C、实验①前20min的平均反应速率 v(H2)=
| △c |
| △t |
| 0.05mol/L-0.0486mol/L |
| 20min |
故选BC.
点评:本题是一道有关热化学、电化学以及化学反应速率和反应限度的综合题,考查角度广,难度大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列实验事实不能说明醋酸是弱电解质的是( )
| A、醋酸溶液的导电性比盐酸弱 |
| B、0.01ml/L醋酸溶液PH>2 |
| C、CH3COONa溶液PH>7 |
| D、将PH=3醋酸溶液稀释100倍,稀释后溶液PH:3<PH<5 |
下列各原子或离子的电子排布式错误的是( )
| A、K+ 1s22s22p63s23p6 |
| B、As 1s22s22p63s23p64s24p3 |
| C、N3- 1s22s22p6 |
| D、Cr 1s22s22p63s23p63d44s2 |
下列关于电解池的叙述不正确的是( )
| A、在电解池的阴极发生还原反应 |
| B、与电源负极相连的是电解池的阳极 |
| C、阴离子移向电解池的阳极 |
| D、电子从电源的负极沿导线流入电解池的阴极 |
我国镍氢电池居世界先进水平.常见镍氢电池的某极是储氢合金LaNi5H6 (LaNi5H6中各元素化合价均为零),电池反应通常表示为LaNi5H6+6NiO(OH)?LaNi5+6Ni(OH)2,下列说法正确的是( )
| A、放电时储氢合金作正极 |
| B、充电时阳极周围c(OH-)增大 |
| C、放电时负极反应:LaNi5H6+6OH--6e-=LaNi5+6H2O |
| D、充电时储氢合金作阳极 |
下列说法正确的是( )
| A、增大反应物浓度,活化分子百分数增大,化学反应速率增大 |
| B、难溶物质可能为强电解质,如BaSO4是强电解质 |
| C、放热反应的反应速率总是大于吸热反应的反应速率 |
| D、KW随浓度的改变而改变 |
1.4g铁全部溶于盐酸中,加入足量NaOH溶液,得红褐色沉淀,过滤后给红褐色沉淀加热(在空气中),最后得到红色物质的质量是( )
| A、2g | B、1.6g |
| C、1g | D、1.8g |
 表示的分子式
表示的分子式 中含有的官能团的名称为
中含有的官能团的名称为