题目内容
(1)由盖斯定律结合下述反应方程式,回答问题:
(1)NH3(g)+HCl(g)=NH4Cl(s)△H=-176KJ/moL
(2)NH3(g)+H2O(l)=NH3﹒H2O(aq)△H=-35.1KJ/moL
(3)HCl(g)+H2O(l)=HCl(aq)△H=-72.3KJ/moL
(4)NH3﹒H2O(aq)+HCl(aq)=NH4Cl(aq)△H=-52.3KJ/moL
则NH4Cl(s)+2H2O(l)=NH4Cl(aq)是 热反应,其反应热的热效应值是 KJ/moL.
(2)在25℃,101KPa下,1克的一氧化碳完全燃烧生成二氧化碳时放热10.1KJ.请写出一氧化碳燃烧热的热化学方式 ,此反应熵的变化情况 (填熵增、熵减、不变).
(3)科学家预言,燃料电池将成为20世纪获得电力的重要途径.用两种或多种碳酸盐的低熔点混合物为电解质,采用吸渗锦粉作阴极,多孔性氧化镁作阳极,以含一氧化碳为主要成分的阳极燃料气,混有CO2的空气为阴极燃气,在650℃电池中发生电极反应,这种电池在国外已经问世.请写出有关的反应式.
负极反应:
正极反应: .
(1)NH3(g)+HCl(g)=NH4Cl(s)△H=-176KJ/moL
(2)NH3(g)+H2O(l)=NH3﹒H2O(aq)△H=-35.1KJ/moL
(3)HCl(g)+H2O(l)=HCl(aq)△H=-72.3KJ/moL
(4)NH3﹒H2O(aq)+HCl(aq)=NH4Cl(aq)△H=-52.3KJ/moL
则NH4Cl(s)+2H2O(l)=NH4Cl(aq)是
(2)在25℃,101KPa下,1克的一氧化碳完全燃烧生成二氧化碳时放热10.1KJ.请写出一氧化碳燃烧热的热化学方式
(3)科学家预言,燃料电池将成为20世纪获得电力的重要途径.用两种或多种碳酸盐的低熔点混合物为电解质,采用吸渗锦粉作阴极,多孔性氧化镁作阳极,以含一氧化碳为主要成分的阳极燃料气,混有CO2的空气为阴极燃气,在650℃电池中发生电极反应,这种电池在国外已经问世.请写出有关的反应式.
负极反应:
正极反应:
考点:反应热和焓变,化学电源新型电池
专题:化学反应中的能量变化
分析:(1)根据盖斯定律结合已知方程式构建目标方程,然后计算反应热;
(2)1克的一氧化碳完全燃烧生成二氧化碳时放热10.1KJ,则28g即1molCO燃烧放出的热量可求,然后写出热化学方程式;反应过程中气体的物质的量减少,则熵减小;
(3)该燃料电池中,负极上一氧化碳失电子和碳酸根离子反应生成二氧化碳,正极上氧气得电子和二氧化碳反应生成碳酸根离子而发生还原反应.
(2)1克的一氧化碳完全燃烧生成二氧化碳时放热10.1KJ,则28g即1molCO燃烧放出的热量可求,然后写出热化学方程式;反应过程中气体的物质的量减少,则熵减小;
(3)该燃料电池中,负极上一氧化碳失电子和碳酸根离子反应生成二氧化碳,正极上氧气得电子和二氧化碳反应生成碳酸根离子而发生还原反应.
解答:
解:(1)(1)NH3(g)+HCl(g)=NH4Cl(s)△H=-176KJ/moL
(2)NH3(g)+H2O(l)=NH3﹒H2O(aq)△H=-35.1KJ/moL
(3)HCl(g)+H2O(l)=HCl(aq)△H=-72.3KJ/moL
(4)NH3﹒H2O(aq)+HCl(aq)=NH4Cl(aq)△H=-52.3KJ/moL
根据盖斯定律:(2)+(4)-(1)+(3)得:
NH4Cl(s)+2H2O(l)=NH4Cl(aq)△H=(-35.1KJ?mol-1)+(-52.3KJ?mol-1)-(-176KJ?mol-1)+(-72.3KJ?mol-1)
即NH4Cl(s)+2H2O(l)=NH4Cl(aq)△H=△H=+16.3KJ?mol-1
所以第(5)个方程式中的反应热是+16.3KJ?mol-1,该反应为吸热反应;
故答案为:吸;+16.3;
(2)1克的一氧化碳完全燃烧生成二氧化碳时放热10.1KJ,则28g即1molCO燃烧放出的热量为28×10.1KJ=282.8kJ,则热化学方程式为CO(g)+
O2(g)=CO2(g)△H=-282.8KJ/moL;反应过程中气体的物质的量减少,则熵减小,所以此反应熵的变化情况熵减;
故答案为:CO(g)+
O2(g)=CO2(g)△H=-282.8KJ/moL;熵减;
(3)该燃料电池中,负极上一氧化碳失电子和碳酸根离子反应生成二氧化碳,电极反应式为2CO-4e-+2CO32-=4CO2,正极上氧气得电子和二氧化碳反应生成碳酸根离子而发生还原反应,电极反应式为:O2+4e-+2CO2=2CO32-,
故答案为:2CO-4e-+2CO32-=4CO2;O2+4e-+2CO2=2CO32-.
(2)NH3(g)+H2O(l)=NH3﹒H2O(aq)△H=-35.1KJ/moL
(3)HCl(g)+H2O(l)=HCl(aq)△H=-72.3KJ/moL
(4)NH3﹒H2O(aq)+HCl(aq)=NH4Cl(aq)△H=-52.3KJ/moL
根据盖斯定律:(2)+(4)-(1)+(3)得:
NH4Cl(s)+2H2O(l)=NH4Cl(aq)△H=(-35.1KJ?mol-1)+(-52.3KJ?mol-1)-(-176KJ?mol-1)+(-72.3KJ?mol-1)
即NH4Cl(s)+2H2O(l)=NH4Cl(aq)△H=△H=+16.3KJ?mol-1
所以第(5)个方程式中的反应热是+16.3KJ?mol-1,该反应为吸热反应;
故答案为:吸;+16.3;
(2)1克的一氧化碳完全燃烧生成二氧化碳时放热10.1KJ,则28g即1molCO燃烧放出的热量为28×10.1KJ=282.8kJ,则热化学方程式为CO(g)+
| 1 |
| 2 |
故答案为:CO(g)+
| 1 |
| 2 |
(3)该燃料电池中,负极上一氧化碳失电子和碳酸根离子反应生成二氧化碳,电极反应式为2CO-4e-+2CO32-=4CO2,正极上氧气得电子和二氧化碳反应生成碳酸根离子而发生还原反应,电极反应式为:O2+4e-+2CO2=2CO32-,
故答案为:2CO-4e-+2CO32-=4CO2;O2+4e-+2CO2=2CO32-.
点评:本题考查了盖斯定律的应用、热化学方程式、熵的变化判断、原电池原理的应用等,题目难度中等,注意把握盖斯定律的含义和燃料电池中电极方程式的书写方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列各种物质在一定条件下都能跟水反应的是( )
①铁、木炭、二氧化硫、纤维素
②镁、硫磺、葡萄糖、乙酸乙酯
③电石、淀粉、蛋白质、氨基酸
④氯气、乙炔、过氧化钠、乙烯
⑤氮化镁、硫化铝、硫铁矿、蔗糖.
①铁、木炭、二氧化硫、纤维素
②镁、硫磺、葡萄糖、乙酸乙酯
③电石、淀粉、蛋白质、氨基酸
④氯气、乙炔、过氧化钠、乙烯
⑤氮化镁、硫化铝、硫铁矿、蔗糖.
| A、②③ | B、①④ |
| C、①⑤ | D、①③④⑤ |
下列事实:
①NaHCO3溶液呈碱性
②NaHSO4溶液呈酸性
③长期使用化肥(NH4)2SO4会使土壤酸性增大,发生板结
④加热能增加纯碱的去污能力
⑤配制CuCl2溶液,用稀盐酸溶解CuCl2固体
⑥明矾能净水
⑦氯化铵溶液可作焊药去除金属制品表面的锈斑
⑧加热FeCl3?6H2O晶体,往往得不到FeCl3固体
⑨NH4F溶液不能用玻璃瓶盛放.其中与盐类水解知识有关的是( )
①NaHCO3溶液呈碱性
②NaHSO4溶液呈酸性
③长期使用化肥(NH4)2SO4会使土壤酸性增大,发生板结
④加热能增加纯碱的去污能力
⑤配制CuCl2溶液,用稀盐酸溶解CuCl2固体
⑥明矾能净水
⑦氯化铵溶液可作焊药去除金属制品表面的锈斑
⑧加热FeCl3?6H2O晶体,往往得不到FeCl3固体
⑨NH4F溶液不能用玻璃瓶盛放.其中与盐类水解知识有关的是( )
| A、全部 | B、除②⑦以外 |
| C、除②以外 | D、除⑨以外 |
下列说法中,正确的是( )
| A、强电解质溶液一定比弱电解质溶液的导电性强 |
| B、强电解质的水溶液中不存在分子 |
| C、SO2和乙醇均属共价化合物,在水中都不能电离,均属非电解质 |
| D、不同的弱电解质只要物质的量浓度相同,电离程度也相同 |
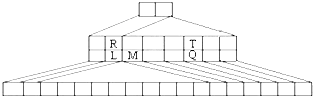 如图是另一种元素周期表--三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是:( )
如图是另一种元素周期表--三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是:( )| A、Q、T两元素的氢化物的稳定性为HnT<HnQ |
| B、L、R的单质与盐酸反应速率为R>L |
| C、M与T形成的化合物有两性 |
| D、L、Q形成的简单离子核外电子数相等 |
已知短周期元素的离子aA2+、bB+、cC3-、dD-具有相同的电子层结构,则下列叙述正确的是( )
| A、原子半径:A>B>C>D |
| B、原子序数:d>c>b>a |
| C、离子半径:C3->D->B+>A2+ |
| D、元素的第一电离能:A>B>D>C |
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
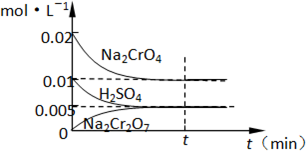 (1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气.结果溶液的PH值不断升高,溶液由酸性转变为碱性.Cr2O72-转化为毒性较低的Cr3+的离子方程式为:
(1)工业酸性废水中含Cr2O72-离子会造成铬污染,排放前先将Cr2O72-还原成Cr3+,并转化成Cr(OH)3除去,工业上采用的方法是向废水中加入NaCl,以铁为电极进行电解,同时鼓入空气.结果溶液的PH值不断升高,溶液由酸性转变为碱性.Cr2O72-转化为毒性较低的Cr3+的离子方程式为: