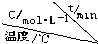题目内容
下列说法正确的是( )
| A、增大反应物浓度,活化分子百分数增大,化学反应速率增大 |
| B、难溶物质可能为强电解质,如BaSO4是强电解质 |
| C、放热反应的反应速率总是大于吸热反应的反应速率 |
| D、KW随浓度的改变而改变 |
考点:化学反应速率的影响因素,强电解质和弱电解质的概念
专题:
分析:A.增大反应物浓度,活化分子数目增多;
B.溶解性与电解质的强弱无关;
C.反应速率与反应的热效应无关;
D.KW随温度的改变而改变.
B.溶解性与电解质的强弱无关;
C.反应速率与反应的热效应无关;
D.KW随温度的改变而改变.
解答:
解:A.增大反应物浓度,活化分子数目增多,有效碰撞的机会增大,反应速率加快,故A错误;
B.溶解性与电解质的强弱无关,则难溶物质可能为强电解质,如BaSO4是强电解质,故B正确;
C.反应速率与反应的热效应无关,不比较放热反应的反应速率与吸热反应的反应速率,故C错误;
D.KW随温度的改变而改变,与浓度无关,故D错误;
故选B.
B.溶解性与电解质的强弱无关,则难溶物质可能为强电解质,如BaSO4是强电解质,故B正确;
C.反应速率与反应的热效应无关,不比较放热反应的反应速率与吸热反应的反应速率,故C错误;
D.KW随温度的改变而改变,与浓度无关,故D错误;
故选B.
点评:本题考查影响化学反应速率的因素,为高频考点,把握活化理论、电解质判断、反应热效应及KW等为解答的关键,侧重分析与应用能力的考查,选项BC为解答的难点,题目难度不大.

练习册系列答案
相关题目
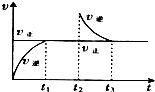 某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H>0,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中不正确的是( )
某恒温密闭容器发生可逆反应Z(?)+W(?)?X(g)+Y(?)△H>0,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件.下列有关说法中不正确的是( )| A、Z和W在该条件下一定不为气态 |
| B、t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量不可能相等 |
| C、若在该温度下此反应平衡常数表达式为K=C(X),则t1~t2时间段与t3时刻后的X浓度相等 |
| D、该反应的平衡常数K随温度升高而增大 |
下列关于氯水的叙述,正确的是( )
| A、氯水中只含Cl2和H2O两种分子 |
| B、新制氯水只能使蓝色石蕊试纸变红 |
| C、光照氯水有气泡逸出,该气体是Cl2 |
| D、氯水放置数天后其pH将变小,酸性增强 |
 一种碳纳米管(氢气)二次电池原理如图.该电池的电解质为6moI/L KOH溶液,下列说法正确的是( )
一种碳纳米管(氢气)二次电池原理如图.该电池的电解质为6moI/L KOH溶液,下列说法正确的是( )| A、储存H2的碳纳米管放电时为负极,充电时为阳极 |
| B、充电时阳极反应为NiO(OH)+H2O+e-=Ni(OH)2+OH- |
| C、放电时正极附近溶液的pH减小 |
| D、放电时负极反应为H2+2OH--2e-=2H2O |
某短周期非金属元素的原子核外最外层电子数是次外层电子数的一半,该元素( )
| A、在自然界中只以化合态的形式存在 |
| B、单质常用作半导体材料和光导纤维 |
| C、最高价氧化物不与任何酸反应 |
| D、气态氢化物很稳定,受热不易分解 |
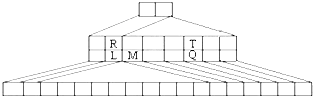 如图是另一种元素周期表--三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是:( )
如图是另一种元素周期表--三角形元素周期表的一部分,图中标示了L、M、Q、R、T元素的位置,下列判断正确的是:( )| A、Q、T两元素的氢化物的稳定性为HnT<HnQ |
| B、L、R的单质与盐酸反应速率为R>L |
| C、M与T形成的化合物有两性 |
| D、L、Q形成的简单离子核外电子数相等 |
下列说法不正确的是( )
①形成化学键的过程一定是化学变化
②离子化合物中一定含有金属元素
③物质有阳离子必有阴离子
④含有金属元素的离子一定为阳离子
⑤单质中一定含有共价键
⑥干冰升华破坏化学键
⑦HCI溶于水中电离出H+和Cl-,因此HCl中含有离子键.
①形成化学键的过程一定是化学变化
②离子化合物中一定含有金属元素
③物质有阳离子必有阴离子
④含有金属元素的离子一定为阳离子
⑤单质中一定含有共价键
⑥干冰升华破坏化学键
⑦HCI溶于水中电离出H+和Cl-,因此HCl中含有离子键.
| A、①②③④⑤⑥⑦ |
| B、②③④⑤⑥⑦ |
| C、③⑤⑥⑦ |
| D、①②③④⑤⑥ |
将下列物质按酸、碱、盐分类排列,正确的是( )
| A、次氯酸 纯碱 硫酸钡 |
| B、硫酸 烧碱 小苏打 |
| C、盐酸 乙醇 氯化钠 |
| D、醋酸 漂白粉 石灰石 |
 纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法: