题目内容
下列叙述正确的是( )
| A、1molH2燃烧放出的热量为H2的燃烧热 |
| B、pH=4的醋酸溶液中,c(CH3COOH)=0.1mol?L-1 |
| C、在NaS溶液中,c(H+)=c(OH-)-2c(H2S)-c(HS-) |
| D、NaCl和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
考点:反应热和焓变,弱电解质在水溶液中的电离平衡,离子浓度大小的比较
专题:化学反应中的能量变化
分析:A、1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热;
B、醋酸是弱酸存在电离平衡,氢离子浓度为10-4mol/L,溶质浓度需要依据电离平衡常数计算;
C、依据溶液中质子守恒列式判断;
D、CH3COONH4溶液中促进水的电离.
B、醋酸是弱酸存在电离平衡,氢离子浓度为10-4mol/L,溶质浓度需要依据电离平衡常数计算;
C、依据溶液中质子守恒列式判断;
D、CH3COONH4溶液中促进水的电离.
解答:
解:A、1mol可燃物完全燃烧生成稳定氧化物放出的热量为燃烧热,1molH2燃烧生成气态水放出的热量不是H2的燃烧热,故A错误;
B、醋酸是弱酸存在电离平衡,氢离子浓度为10-4mol/L,溶质浓度需要依据电离平衡常数计算,故B错误;
C、依据溶液中质子守恒列式判断,在NaS溶液中,存在着质子守恒,水电离出氢离子和氢氧根离子相同:c(H+)=c(OH-)-2c(H2S)-c(HS-)关系正确,故C正确;
D、CH3COONH4溶液中促进水的电离,氯化钠对水电离无影响,所以水的电离程度不相同,故D错误;
故选C.
B、醋酸是弱酸存在电离平衡,氢离子浓度为10-4mol/L,溶质浓度需要依据电离平衡常数计算,故B错误;
C、依据溶液中质子守恒列式判断,在NaS溶液中,存在着质子守恒,水电离出氢离子和氢氧根离子相同:c(H+)=c(OH-)-2c(H2S)-c(HS-)关系正确,故C正确;
D、CH3COONH4溶液中促进水的电离,氯化钠对水电离无影响,所以水的电离程度不相同,故D错误;
故选C.
点评:本题考查了电解质溶液中离子浓度关系,弱电解质电离平衡分析,盐类水解的分析判断,掌握基础是关键,题目难度中等.

练习册系列答案
 考前必练系列答案
考前必练系列答案
相关题目
下列过程中,需要降低化学反应速率的是( )
| A、制取氨气 | B、食物腐烂 |
| C、工业炼钢 | D、硫酸的生产 |
已知:CaCO3(s)?CaO(s)+CO2(g)△H>0,△S>0,则该反应能自发进行的条件是( )
| A、低温 |
| B、高温 |
| C、任何温度下都能自发进行 |
| D、任何温度下都不能自发进行 |
如图甲池和乙池中的四个电极都是铂电极,乙池为K1溶液.请根据图示判断下列有关说法正确的是( )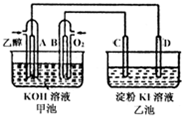

| A、甲池是电解池,乙池是原电池 |
| B、原电池的正极反应式为:C2H5OH+16OH-+12e-=2CO32-+11H2O |
| C、反应一段时间后,两池溶液的pH均未变化 |
| D、反应一段时间后,C极附近溶液变蓝 |
W,X,Y,Z是周期表中四种短周期元素,原子序数依次增大,W,X和Y,Z分别同周期,X,Y同主族,W的气态氢化物可以与最高价含氧酸反应生成离子化合物,由此可知:( )
| A、X,Y,Z中最简单氢化物稳定性最弱的是Y |
| B、Z元素氧化物对应水化物的酸性一定强于Y元素氧化物对应水化物的酸性 |
| C、X2-的还原性大于Y2- |
| D、Z元素单质在化学反应中只表现出氧化性 |
下列关于物质的量浓度表述正确的是( )
| A、0.3mol?L-1Na2SO4溶液中含有Na+和SO42-总物质的量为0.9mol |
| B、当1L水吸收22.4L(标准状况)氨气时所得氨水的浓度是1mol?L-1 |
| C、在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量浓度相等,则K+和Cl-的物质的量浓度一定相同 |
| D、10℃的0.35mol?L-1的KCl饱和溶液100mL,蒸发掉5g水,冷却到10℃时过滤,其滤液中溶质的物质的量浓度仍为0.35mol?L-1 |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、CO和N2互为等电子体,常温常压下,22.4L的CO与1monN2所含的电子数相等 |
| B、7.8gNa2S和Na2O2的混合物中含有的阴离子数大于0.1N |
| C、1.0L0.1mol/L的醋酸溶液中含CH3COOH、CH3COO-粒子总数为0.1NA |
| D、5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA |
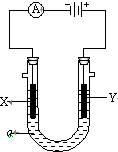 如图表示一个精炼粗铜的电解池,电解液a选用CuSO4溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
如图表示一个精炼粗铜的电解池,电解液a选用CuSO4溶液,X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: