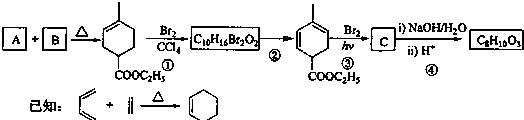
题目内容
下列物质中既含有共价键又含离子键的化合物是( )
| A、NaCl |
| B、Al2O3 |
| C、NaOH |
| D、C6H6 |
考点:化学键
专题:
分析:一般来说,活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,据此分析解答.
解答:
解:A.NaCl中钠离子和氯离子之间只存在离子键,为离子化合物,故A错误;
B.Al2O3中只有铝离子与氧离子形成的离子键,为离子化合物,故B错误;
C.NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,为离子化合物,故C正确;
D.C6H6中相邻碳原子之间、C原子和氢原子之间都只含有存在共价键,为共价化合物,故D错误;
故选C.
B.Al2O3中只有铝离子与氧离子形成的离子键,为离子化合物,故B错误;
C.NaOH中钠离子和氢氧根离子之间存在离子键、O原子和H原子之间存在共价键,为离子化合物,故C正确;
D.C6H6中相邻碳原子之间、C原子和氢原子之间都只含有存在共价键,为共价化合物,故D错误;
故选C.
点评:本题主要考查化学键,熟悉判断化学键的一般规律即可解答,题目难度不大.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案
相关题目
对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应为:11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4.下列关于该反应的说法正确的是( )
| A、CuSO4发生了氧化反应 |
| B、氧化产物和还原产物的物质的量之比为5:6 |
| C、白磷只作还原剂 |
| D、该反应中被硫酸铜氧化的白磷有3mol |
下列有关说法正确的是( )
| A、反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | ||||
| B、铅蓄电池放电过程中,正极质量增加,负极质量减小 | ||||
C、25℃下,在NH3?H2O稀溶液中,加水,
| ||||
| D、在NaHS溶液中,滴入少量CuCl2溶液产生黑色沉淀,HS-水解程度增大,pH增大 |
如图甲池和乙池中的四个电极都是铂电极,乙池为K1溶液.请根据图示判断下列有关说法正确的是( )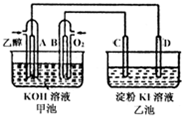

| A、甲池是电解池,乙池是原电池 |
| B、原电池的正极反应式为:C2H5OH+16OH-+12e-=2CO32-+11H2O |
| C、反应一段时间后,两池溶液的pH均未变化 |
| D、反应一段时间后,C极附近溶液变蓝 |
我们生活在千变万化的物质世界里.下列变化中,没有发生氧化还原反应的是( )
| A、爆竹爆炸 | B、木炭燃烧 |
| C、蒸发 | D、电解水 |
下列关于物质的量浓度表述正确的是( )
| A、0.3mol?L-1Na2SO4溶液中含有Na+和SO42-总物质的量为0.9mol |
| B、当1L水吸收22.4L(标准状况)氨气时所得氨水的浓度是1mol?L-1 |
| C、在K2SO4和NaCl的中性混合水溶液中,如果Na+和SO42-的物质的量浓度相等,则K+和Cl-的物质的量浓度一定相同 |
| D、10℃的0.35mol?L-1的KCl饱和溶液100mL,蒸发掉5g水,冷却到10℃时过滤,其滤液中溶质的物质的量浓度仍为0.35mol?L-1 |
化学与生活密切相关.下列生活中常见物质的俗名或名称与化学式相对应的是( )
| A、小苏打--Na2CO3 |
| B、烧碱--NaOH |
| C、甲醛--CH3OH |
| D、明矾--KAl(SO4)2 |
下列离子方程式正确的是( )
| A、向100mL 0.1mol/L的FeSO4溶液中,加入0.01mol Na2O2固体2Fe2++2Na2O2+2H2O═4Na++2Fe(OH)2+O2↑ |
| B、向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
| C、在硫酸工业中,对尾气中的SO2用过量的氨水吸收的反应:NH3?H2O+SO2=NH4++HSO3- |
| D、向20mL 0.5mol/L FeBr2溶液中通入448mL Cl2(标准状况)2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2. |