题目内容
低碳循环正成为科学家研究的主要课题.最近有科学家提出由空气等原料合成燃料甲醇的构想,其技术流程图如下:请按要求回答下列问题:
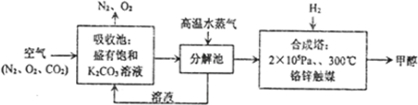
(1)吸收池中反应的化学方程式为: .
(2)向分解池中通入高温水蒸气的作用是 .
(3)已知在2×105Pa、300℃下:
①2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-akJ/mol
②2H2(g)+O2(g)=2H2O(g)△H=-bkJ/mol
写出合成塔中合成甲醇的热化学方程式(已知此反应为放热反应):
(4)利用合成的甲醇,再设计甲醇-空气燃料电池,其电解质溶液为KOH溶液,该电池负极反应式为 ;当消耗11.2LO2(标准状况下)时,理论上转移电子的数目为 .
(5)利用甲醇等含碳燃料不完全燃烧时产生的混合气CO(g)和H2O(g)在一定条件下反应可得到清沽燃料H2.现将三组CO(g)和H2O的混合气分别通入到体积为2L的恒容密闭容器中,一定条件下反应为CO(g)+H2O(g)?CO2(g)+H2(g),得知如下数据:
①实验1前6min的反应速率v(CO2)= .
②实验2条件下平衡常数K= ;该反应的△H 0(填“<”或“>”).
③实验3中,若平衡时的转化率α(CO)>α(H2O),则
的取值范围是 .
④若实验2、3平衡时各组分体积分数相等,则投料量a、b满足关系式: .

(1)吸收池中反应的化学方程式为:
(2)向分解池中通入高温水蒸气的作用是
(3)已知在2×105Pa、300℃下:
①2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(g)△H=-akJ/mol
②2H2(g)+O2(g)=2H2O(g)△H=-bkJ/mol
写出合成塔中合成甲醇的热化学方程式(已知此反应为放热反应):
(4)利用合成的甲醇,再设计甲醇-空气燃料电池,其电解质溶液为KOH溶液,该电池负极反应式为
(5)利用甲醇等含碳燃料不完全燃烧时产生的混合气CO(g)和H2O(g)在一定条件下反应可得到清沽燃料H2.现将三组CO(g)和H2O的混合气分别通入到体积为2L的恒容密闭容器中,一定条件下反应为CO(g)+H2O(g)?CO2(g)+H2(g),得知如下数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需要的时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
| 2 | 900 | 1 | 2 | 0.5 | 0.5 | - |
| 3 | 900 | a | b | c | d | - |
②实验2条件下平衡常数K=
③实验3中,若平衡时的转化率α(CO)>α(H2O),则
| a |
| b |
④若实验2、3平衡时各组分体积分数相等,则投料量a、b满足关系式:
考点:化学平衡的计算,用盖斯定律进行有关反应热的计算,原电池和电解池的工作原理
专题:
分析:(1)吸收池中是碳酸钾吸收二氧化碳的反应;
(2)KHCO3受热易分解;
(3)依据热化学方程式和盖斯定律计算得到;
(4)甲醇燃烧的反应原理,设计如图所示的电池装置,甲醇在负极失电子发生氧化反应,正极是氧气得到电子生成氢氧根离子,依据原电池原理分析书写电极反应;根据消耗一个氧气,转移4个电子进行计算;
(5)①根据v=
计算反应速率;
②根据平衡常数表达式计算出实验2的平衡常数;根据温度变化,平衡时的生成物的物质的量的多少判断平衡移动的方向,判断反应热的符号;
③由于CO与H2O的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等,要使CO转化率大于H2O的转化率,则增大H2O的物质的量;
④若实验2、3平衡时各组分体积分数相等,则实验2、3等效,又CO(g)+H2O(g)?CO2(g)+H2(g)是反应前后气体体积不变的反应,所以只要成比例即可.
(2)KHCO3受热易分解;
(3)依据热化学方程式和盖斯定律计算得到;
(4)甲醇燃烧的反应原理,设计如图所示的电池装置,甲醇在负极失电子发生氧化反应,正极是氧气得到电子生成氢氧根离子,依据原电池原理分析书写电极反应;根据消耗一个氧气,转移4个电子进行计算;
(5)①根据v=
| △c |
| △t |
②根据平衡常数表达式计算出实验2的平衡常数;根据温度变化,平衡时的生成物的物质的量的多少判断平衡移动的方向,判断反应热的符号;
③由于CO与H2O的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等,要使CO转化率大于H2O的转化率,则增大H2O的物质的量;
④若实验2、3平衡时各组分体积分数相等,则实验2、3等效,又CO(g)+H2O(g)?CO2(g)+H2(g)是反应前后气体体积不变的反应,所以只要成比例即可.
解答:
解:(1)吸收池中是碳酸钾吸收二氧化碳的反应,方程式为:CO2+K2CO3+H2O=2KHCO3↓,故答案为:CO2+K2CO3+H2O=2KHCO3↓;
(2)KHCO3受热易分解,向分解池中通入高温水蒸气,提供高温环境使KHCO3分解,故答案为:提供高温环境使KHCO3分解;
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-akJ/mol
②2H2(g)+O2(g)=2H2O(g)△H=-bkJ/mol
依据盖斯定律
得到合成甲醇的热化学方程式:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=
KJ/mol=
KJ/mol,
故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=
KJ/mol;
(4)甲醇燃烧的反应原理,设计如图所示的电池装置,甲醇在负极失电子发生氧化反应,CH3OH+8OH--6e-=CO32-+6H2O,根据消耗一个氧气,转移4个电子,则消耗11.2LO2(标准状况下)时,理论上转移电子的数目为
×6.02×10 23×4=1.204×1024
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;1.204×1024;
(5)①因为5分钟达平衡,所以前6min的反应速率即为5分钟达平衡时的速率,v(CO2)=
=0.15mol/(L.min),故答案为:0.15 mol/(L.min);
②实验2中达到平衡时,c(CO2)=c(H2)=
=0.25mol/L,c(CO)=
=0.25mol/L,c(H2O)=
=0.75mol/L,
K=
=
;根据CO(g)+H2O(g)?CO2(g)+H2(g)可知压强对平衡移动无影响,如果在650℃,H2O、CO的物质的量改为1mol、2mol,达到平衡时CO的物质的量应为0.75,而900℃时CO的物质的量应为0.5mol,说明升高温度平衡向逆反应方向移动,则正反应为放热反应,即△H<0,
故答案为:
;<;
③根由于CO与H2O的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等.要使CO转化率大于H2O的转化率,则增大H2O的物质的量,即
的值小于1,所以
的取值范围是0<
<1,
故答案为:0<
<1;
④若实验2、3平衡时各组分体积分数相等,则实验2、3等效,又CO(g)+H2O(g)?CO2(g)+H2(g)是反应前后气体体积不变的反应,所以只要成比例即可,即
=
,即b=2a,故答案为:b=2a.
(2)KHCO3受热易分解,向分解池中通入高温水蒸气,提供高温环境使KHCO3分解,故答案为:提供高温环境使KHCO3分解;
(3)①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H=-akJ/mol
②2H2(g)+O2(g)=2H2O(g)△H=-bkJ/mol
依据盖斯定律
| ②×3-① |
| 2 |
| -b×3+a |
| 2 |
| a-3b |
| 2 |
故答案为:CO2(g)+3H2(g)=CH3OH(l)+H2O(l)△H=
| a-3b |
| 2 |
(4)甲醇燃烧的反应原理,设计如图所示的电池装置,甲醇在负极失电子发生氧化反应,CH3OH+8OH--6e-=CO32-+6H2O,根据消耗一个氧气,转移4个电子,则消耗11.2LO2(标准状况下)时,理论上转移电子的数目为
| 11.2 |
| 22.4 |
故答案为:CH3OH+8OH--6e-=CO32-+6H2O;1.204×1024;
(5)①因为5分钟达平衡,所以前6min的反应速率即为5分钟达平衡时的速率,v(CO2)=
| ||
| 5 |
②实验2中达到平衡时,c(CO2)=c(H2)=
| 0.5 |
| 2 |
| 1-0.5 |
| 2 |
| 2-0.5 |
| 2 |
K=
| 0.25×0.25 |
| 0.25×0.75 |
| 1 |
| 3 |
故答案为:
| 1 |
| 3 |
③根由于CO与H2O的化学计量数相等都为1,所以当两者物质的量相等时二者转化率相等.要使CO转化率大于H2O的转化率,则增大H2O的物质的量,即
| a |
| b |
| a |
| b |
| a |
| b |
故答案为:0<
| a |
| b |
④若实验2、3平衡时各组分体积分数相等,则实验2、3等效,又CO(g)+H2O(g)?CO2(g)+H2(g)是反应前后气体体积不变的反应,所以只要成比例即可,即
| a |
| b |
| 1 |
| 2 |
点评:本题考查了盖斯定律的应用、原电池原理、反应速率的计算、平衡常数的计算与运用、溶度积的有关计算等,题目综合性较强,是对学生能力的考查,难度中等,注意把握反应原理的有关内容.

练习册系列答案
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案
相关题目
硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质.则下列说法正确的是( )

| A、CO、SO2、SO3均是酸性氧化物 |
| B、工业上利用Cl2和澄清石灰水反应来制取漂白粉 |
| C、除去与水反应,图3所示转化反应均为氧化还原反应 |
| D、用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100% |
2006年5月15日,国家食品药品监督管理局通报查处了齐齐哈尔第二制药有限公司使用工业溶剂二甘醇(HO-CH2-CH2-O-CH2-CH2-OH)代替药用溶剂丙二醇(HO-CH2-CH2-CH2-OH)的事件.最新统计,目前确定齐齐哈尔第二制药有限公司生产的“亮菌甲素”假药造成的死亡人数已有9人.下列关于二甘醇说法正确的是( )
| A、二甘醇和丙二醇性质完全相同 |
| B、二甘醇和丙二醇互为同系物 |
| C、二甘醇沸点可能比丙二醇高 |
| D、二甘醇在人体中的降解产物草酸(HOOC-COOH)对人体有害 |
NA表示阿伏加德罗常数,下列说法正确的是( )
| A、25℃时,2LpH=1的H2SO4溶液中,SO42-数目为0.1NA | ||
| B、300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA | ||
C、标准状况下,V L CHCl3含有的碳原子数为
| ||
| D、1 mol OH-参与电解,反应过程中转移的电子数为NA |
金属单质与足量Cl2反应后,生成物的化学式中,不正确的是( )
| A、FeCl2 |
| B、AlCl3 |
| C、MgCl2 |
| D、CuCl2 |

 某研究性学习小组对过量炭粉与氧化铁(Fe2O3)反应的气体产物成分进行研究.
某研究性学习小组对过量炭粉与氧化铁(Fe2O3)反应的气体产物成分进行研究.