题目内容
已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10.现向1L2mol/LHF溶液中加入1L 0.2mol/LCaCl2溶液,则下列说法中,正确的是( )
| A、25℃时,0.1 mol/LHF溶液中pH=1 |
| B、Ksp(CaF2)随温度和浓度的变化而变化 |
| C、该体系中没有沉淀产生 |
| D、该体系中HF与CaCl2反应产生沉淀 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:
分析:A、HF酸为弱酸,不能完全电离;
B、Ksp只与温度有关;
C、Qc>Ksp,说明有沉淀产生;
D、Qc>Ksp,说明有沉淀产生.
B、Ksp只与温度有关;
C、Qc>Ksp,说明有沉淀产生;
D、Qc>Ksp,说明有沉淀产生.
解答:
解:A、HF酸为弱酸,不能完全电离,则25℃时,0.1 mol?L-1HF溶液中pH>1,故A错误;
B、Ksp只与温度有关,则Ksp(CaF2)随温度的变化而变化,与浓度无关,故B错误;
C、两溶液混合后,c(Ca2+)=0.1 mol?L-1,c(F-)Ka(HF)=3.6×10-4=
,c(F-)=6×10-3mol/L,则Qc=c2(F-)?c(Ca2+)=(6×10-3mol/L)?0.1 mol?L-1=6×10-4>Ksp,说明有沉淀产生,故C错误;
D、两溶液混合后,c(Ca2+)=0.1 mol?L-1,c(F-)Ka(HF)=3.6×10-4=
,c(F-)=6×10-3mol/L,则Qc=c2(F-)?c(Ca2+)=(6×10-3mol/L)2?0.1 mol?L-1=6×10-4>Ksp,说明有沉淀产生,故D正确;
故选D.
B、Ksp只与温度有关,则Ksp(CaF2)随温度的变化而变化,与浓度无关,故B错误;
C、两溶液混合后,c(Ca2+)=0.1 mol?L-1,c(F-)Ka(HF)=3.6×10-4=
| [F-]2 |
| [HF] |
D、两溶液混合后,c(Ca2+)=0.1 mol?L-1,c(F-)Ka(HF)=3.6×10-4=
| [F-]2 |
| [HF] |
故选D.
点评:本题考查平衡常数及沉淀的生成,注意利用溶度积判断沉淀能否生成,把握影响平衡常数的因素即可解答,题目难度中等.

练习册系列答案
相关题目
用惰性电极电解一定浓度的CuSO4溶液,通电一段时间后,向所得的溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH.则下列说法正确的是( )
| A、电解过程中阴极没有气体生成 |
| B、电解过程中转移的电子的物质的量为0.4 mol |
| C、原CuSO4溶液的浓度为0.1 mol?L-1 |
| D、电解过程中阳极收集到的气体体积为1.12 L(标况下) |
除去括号内杂质所用试剂和方法不正确的是( )
| A、Cu(Fe)--稀盐酸,过滤 |
| B、KNO3(NaCl)--结晶 |
| C、水(NaCl)--蒸馏 |
| D、CO2(HCl)--氢氧化钠溶液,洗气 |
可以用于鉴别淀粉溶液和蛋白质溶液的方法是( )
| A、分别加入碘水,观察颜色反应 |
| B、分别加热,观察是否生成沉淀 |
| C、加入淀粉酶观察是否水解 |
| D、分别灼烧,闻味道 |
下列叙述中,正确的是( )
| A、熵变小于零而焓变大于零的反应肯定不能发生 |
| B、用蒸馏水稀释0.1mol/L的醋酸至0.01mol/L,稀释过程中温度维持25℃不变,溶液中各离子浓度均减小 |
| C、已知2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,则H2燃烧热为241.8 kJ/mol |
| D、已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2;则△H1<△H2 |
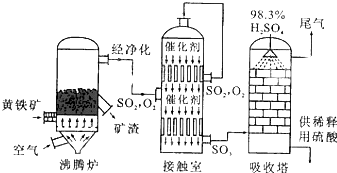 工业上常用硫磺矿或黄铁矿为原料生产硫酸,我国主要以黄铁矿为主,下面是用黄铁矿为原料生产硫酸的工艺流程图:
工业上常用硫磺矿或黄铁矿为原料生产硫酸,我国主要以黄铁矿为主,下面是用黄铁矿为原料生产硫酸的工艺流程图:


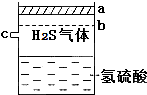 已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度…在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示.
已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度…在密闭容器里盛有饱和H2S溶液和H2S气体,可上下移动的活塞停止在a处,如图所示.